
| A. | 阴极:2H++2e-═H2↑阳极:4OH--4e-═2H2O+O2↑ | |
| B. | 阴极:2H++2e-═H2↑阳极:2Cl--2e-═Cl2↑ | |
| C. | 阴极:Cu2++2e-═Cu阳极:4OH--4e-═2H2O+O2↑ | |
| D. | 阴极:Cu2++2e-═Cu阳极:2Cl--=2e-═Cl2↑ |
分析 A、当氯离子和铜离子全部电解放电后电解的是水;
B、铜离子放电后,阳极还有氯离子放电;
C、溶液中氯离子浓度大于铜离子浓度,氯离子放电完全时铜离子已全部得到电子放电;
D、开始时阳极氯离子放电,阴极铜离子同时放电.
解答 解:A、当氯离子和铜离子全部电解放电后电解的是水;阴极:Cu2++2e-=Cu 2H++2e-=H2↑;
阳极:2Cl--2e-=Cl2↑、4OH--4e-=2H2O+O2↑,故A可以同时发生,故A不选;
B、铜离子放电后,阳极还有氯离子放电;阴极:Cu2++2e-=Cu、2H++2e-=H2↑,阳极:2Cl--2e-=Cl2↑,故B可以同时发生,故B不选;
C、溶液中氯离子浓度大于铜离子浓度,氯离子放电完全时铜离子已全部得到电子放电;阴极:Cu2++2e-=Cu、2H++2e-=H2↑,阳极:2Cl--2e-=Cl2↑,故C不可以同时发生,故C选;
D、开始时阳极氯离子放电,阴极铜离子同时放电;阴极:Cu2++2e-=Cu,阳极:2Cl--2e-=Cl2↑,故D可以同时发生,故D不选;
故选C.
点评 本题考查了混合电解的原理应用,主要考查了离子放电顺序的应用,混合电解时,溶液中的离子按照氧化性和还原性强弱的顺序进行放电,离子物质的量不同电解情况不同,但总的原则是两极电子守恒是计算和判断的关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
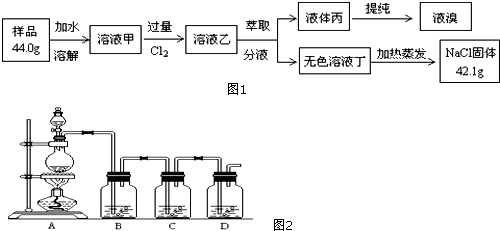
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 SO2、NO、NO2、CO都是污染大气的有害物质,对其进行回收利用是节能减排的重要课题.
SO2、NO、NO2、CO都是污染大气的有害物质,对其进行回收利用是节能减排的重要课题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
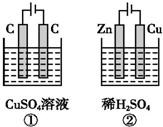 如图所示的两个实验装置中,溶液的体积均为 200mL,开始时电解质溶液的浓度均为 0.1mol•L-1,工作一段时间后,测得两端导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
如图所示的两个实验装置中,溶液的体积均为 200mL,开始时电解质溶液的浓度均为 0.1mol•L-1,工作一段时间后,测得两端导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )| A. | 产生气体的总体积:①>② | |
| B. | 电极上析出物质的总质量:②>① | |
| C. | 溶液的pH变化:①增大,②减小 | |
| D. | ①中阳极的电极反应式:4OH--4e-═2H2O+O2↑;②中阴极的电极反应式:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:K+、Fe2+、Cl-、NO3- | |
| B. | 加入Al能放出H2的溶液中:NH+4、Cl-、SO2-4、HCO-3 | |
| C. | 在含有大量Fe3+的溶液中:NH4+、Cl-、Na+、SCN- | |
| D. | 由水电离的c(OH-)=10-13mol•L-1的溶液中:Ba2+、Cl-、Na+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=11的Na2SO3溶液中,水电离的c(H+)=1.0×10-11mol/L | |
| B. | 将0.2mol•L-1盐酸与0.1mol•L-1的KAlO2溶液等体积混合,溶液中离子浓度由小到大的顺序:c(OH-)<c(Al3+)<c(H+)<c(K+)<c(Cl-) | |
| C. | 浓度相同的①NH4Cl②(NH4)2SO4③(NH4)2CO3④NH4HSO4四种溶液,c(NH4+)大小顺序为:②>③>④>① | |
| D. | pH=4的NaHC2O4溶液中存在:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1K2SO4溶液中含有K+的数目为2NA | |
| B. | 标准状况下,2.24L氯仿(CHCl3)中含有C-Cl数目为0.3NA | |
| C. | 18g重水中所含有的中子数为10NA | |
| D. | 1molNa与O2在一条条件下反应生成Na2O和Na2O2的混合物的转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 27% | B. | 28% | C. | 54% | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com