
【题目】填写下列空白:
(1)含有6.02×1023个H的H2O,其物质的量是________mol;某硫酸钠溶液中含有3.01×1023个Na+,则溶液中SO42-的物质的量是 ____________mol,该溶液中Na2SO4的质量为 ______________g。
(2)_____________mol H2O中含有的氧原子数与1.5 mol CO2中含有的氧原子数相等。
(3)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为______________。
(4)已知16gA和20gB恰好完全反应生成0.04molC和31.76gD,则C的摩尔质量为 ________。
【答案】0.5 0.25 35.5 3 17∶16 106g·mol-1
【解析】
(1)因为每个H2O分子中含有2个H原子,所以含有6.02×1023个H的H2O的物质的量是![]() ×
×![]() =0.5mol;根据硫酸钠电离方程式Na2SO4=2Na++SO42-可知,溶液中n(Na+):n(SO42-)=2:1,因3.01×1023个Na+的物质的量是
=0.5mol;根据硫酸钠电离方程式Na2SO4=2Na++SO42-可知,溶液中n(Na+):n(SO42-)=2:1,因3.01×1023个Na+的物质的量是![]() =0.5mol,所以SO42-的物质的量是
=0.5mol,所以SO42-的物质的量是![]() ×n(Na+)=
×n(Na+)=![]() ×0.5mol=0.25mol,根据计量关系可知,该溶液中Na2SO4的物质的量为0.25mol,0.25molNa2SO4的质量为0.25mol×142g/mol=35.5g。
×0.5mol=0.25mol,根据计量关系可知,该溶液中Na2SO4的物质的量为0.25mol,0.25molNa2SO4的质量为0.25mol×142g/mol=35.5g。
(2)根据每个H2O分子中含有1个氧原子,每个CO2分子中含有2个氧原子,则1.5molCO2中含氧原子的物质的量为1.5mol×2=3mol,含3mol氧原子的H2O的物质的量为3mol。
(3)NH3和CH4混合不发生反应,设混合气体中NH3和CH4各1mol,则混合气体中NH3与CH4的质量比m(NH3):m(CH4)=(1mol×17g/mol):(1mol×16g/mol)=17:16。
(4)根据质量守恒,生成0.04molC的质量为(16g+20g)-31.76g=4.24g,则C的摩尔质量是![]() =106g/mol。
=106g/mol。


科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环,有效降低碳排放。
(1)在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJmol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJmol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。
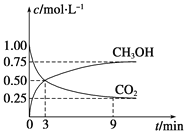
①计算:从0min到3min,H2的平均反应速率v(H2)=_______mol·L-1·min-1,反应至平衡时,放出的热量是_______kJ。
②能说明上述反应达到平衡状态的是________(填编号)。
A.c(CO2) ∶c(CH3OH)=1∶1
B.混合气体的密度不再发生变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
③反应达到平衡后,保持其他条件不变,能加快反应速率且使体系中气体的物质的量减少,可采取的措施有________(填编号)。
A.升高温度 B.缩小容器体积
C.再充入CO2气体 D.使用合适的催化剂
(2)已知A(g)+B(g) ![]() C(g)+D(g) ΔH,反应的平衡常数和温度的关系如下:
C(g)+D(g) ΔH,反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | x | 0.6 | 0.4 |
回答下列问题:
①该反应是_____反应(填“放热”或“吸热”)。
②830℃时,向一个2L的密闭容器中充入0.20mol的A和0.80mol的B,反应至10s时达到平衡,测得A的转化率为80%,计算830℃时,反应的平衡常数x=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国稀土资源丰富。下列有关稀土元素![]() 与
与![]() 的说法正确的是( )
的说法正确的是( )
A. ![]() 与
与![]() 的质量数相同
的质量数相同
B. ![]() 与
与![]() 是同一种核素
是同一种核素
C. ![]() 与
与![]() 互为同位素
互为同位素
D. ![]() 与
与![]() 的核外电子数和中子数均为62
的核外电子数和中子数均为62
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A. 从1L 1mol·L-1的NaCl溶液中取出10mL,其浓度仍是1mol·L-1
B. 40g NaOH溶于1L的水中所得的溶液中NaOH物质的量浓度是1mol·L-1
C. 0.5L 2mol·L-1 BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D. 制成0.5L 10mol·L-1的盐酸,需要氯化氢气体112L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国有句古语:“一方水土养一方人”,饮水是提供人体必需的矿物质和微量元素重要途径之一。在天然无污染的泉水中,含有Cu、K、Ca、Zn、P、Mg、Na、Fe等人体必需元素,其中属于大量元素的是
A. Cu、K、Ca、ZnB. K、Ca、P、MgC. P、Cu、Na、FeD. Ca、Zn、P、Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液240 mL;
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为__________________________________,
本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、____________________。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如下图所示。烧杯的实际质量为________g,要完成本实验该同学应称出________g NaOH。

(3)下列对容量瓶及其使用方法的描述中正确的是(____)
A.容量瓶上标有容积、温度和浓度
B.容量瓶用蒸馏水洗净后,必须烘干
C.配制溶液时,把量好的浓硫酸小心倒入容量瓶中,加入蒸馏水到接近刻度线1~2 cm处,改用胶头滴管滴加蒸馏水至刻度线
D.使用前要检查容量瓶是否漏水
(4)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是_______________。
①转移溶液时不慎有少量洒到容量瓶外面
②定容时俯视刻度线
③未冷却到室温就将溶液转移到容量瓶并定容
④定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
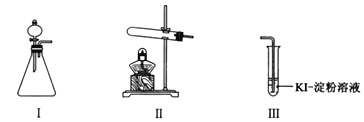
供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体。
(1)小组同学设计甲、乙、丙三组实验,记录如下:
操作 | 现象 | |
甲 | 向I的锥形瓶中加入______,向I的______中加入30% H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是__________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________________________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列________溶液(填序号),证明了白雾中含有H2O2。
A.酸性KMnO4 B.FeCl2 C.氢硫酸 D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI +O2 +2H2O=2I2 + 4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)_____________________造成的,请设计实验证明他们的猜想是否正确。_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在国民经济中占有重要地位。完成合成氨工业中有关问题。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
①高温高压、催化剂条件下,工业合成氨的热化学方程式为:____________________________________________。
②若起始时向容器内放入0.2 mol N2和0.6 mol H2,达到平衡后放出的热量为Q,则Q值______18.44 kJ(填“﹥”“=”或“﹤”)。
(2)NH3(g)与CO2(g) 经过两步反应合成尿素(CO(NH2)2),两步反应的能量变化示意图如下:

①则2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(l) ΔH=_________kJ/mol。
CO(NH2)2(s)+H2O(l) ΔH=_________kJ/mol。
②在一定温度和压强下,若①中的反应,NH3和CO2的物质的量之比(氨碳比)n(NH3)/n(CO2)=x。下图是氨碳比(x)与CO2平衡转化率(α)的关系。

α随着x增大而增大的原因是_________________________________。
③图中B点处,NH3的平衡转化率_______________。
(3)将N2和H2各1 mol充入一密闭容器中,在一定条件下发生合成氨反应。反应至平衡的过程中,N2的体积分数将_______________(填序号)。
a.一直减小 b.始终不变 c.一直增大 d.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com