
| A、碳酸氢钠溶液水解的离子方程式:HCO3-+H2O?H3O++CO32- |
| B、足量乙酸与碳酸钠反应的离子方程式:2H++CO32-═CO2↑+H2O |
| C、铁吸氧腐蚀的正极反应:2H2O+O2+4e-═4OH- |
| D、H2SO3的电离方程式H2SO3?2H++SO32- |


科目:高中化学 来源: 题型:
 的烃跟D2以等物质的量混合,并在一定条件下反应,所得产物的结构简式可能是(其中加重氢原子的碳原子均为*号标记)( )
的烃跟D2以等物质的量混合,并在一定条件下反应,所得产物的结构简式可能是(其中加重氢原子的碳原子均为*号标记)( )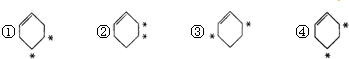
| A、①② | B、②③ | C、①③ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、最外层都只有1个电子,在化学反应中容易失去1个电子表现出强还原性 |
| B、单质的熔点和沸点依次降低 |
| C、单质都能与水反应生成碱,都能在空气中燃烧生成过氧化物 |
| D、原子半径逐渐增大,单质与水反应的剧烈程度逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、NaOH的电子式: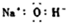 |
| B、I4O9(碘酸碘)中碘的化合价为+3,+5 |
C、NH3的结构与NH4Cl相似,NH5的结构式为: |
D、CO2的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A和B的原子序数之差为8 |
| B、A和B原子最外层电子数之和为8 |
| C、A和B原子最外层电子数之和为3 |
| D、A、B原子核外电子数总和可能为11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、都正确 | B、①②③ |
| C、②③④ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、①③⑥ |
| C、③④⑤ | D、②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com