
【题目】常温下,将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L混合溶液。
(1)该溶液中存在的三个平衡体系是 、 、 。(用离子方程式表示)
(2)溶液中共有 种不同的粒子。
(3)这些粒子中浓度为0.01mol/L的是 ,浓度为0.002mol/L的是 。
(4)物质的量之和为0.01mol的二种粒子是 。
(5) 和 两种粒子数量之和比OH-多0.008mol。
【答案】(1)NH3·H2O![]() NH4++OH-、NH4++H2O
NH4++OH-、NH4++H2O![]() NH3·H2O+H+、H2O
NH3·H2O+H+、H2O![]() H++OH-;
H++OH-;
(2)7(3)Cl-,Na+;(4)NH4+、NH3·H2O;(5)NH4+、H+。
【解析】
试题分析:(1)NH4Cl+NaOH=NH3·H2O+NaCl,根据反应物用量可知反应后溶液溶质为NH3·H2O、NaCl、NH4Cl,因此存在平衡体系是:NH3·H2O![]() NH4++OH-、NH4++H2O
NH4++OH-、NH4++H2O![]() NH3·H2O+H+,溶液中有水,水是弱电解质,存在电离平衡,即H2O
NH3·H2O+H+,溶液中有水,水是弱电解质,存在电离平衡,即H2O![]() H++OH-;
H++OH-;
(2)根据以上分析可知溶液中存在的微粒有Cl-、NH4+ 、Na+、OH-、H+、H2O、NH3·H2O,共计是7种;
(3)Cl-不水解,因此c(Cl-)=0.01mol·L-1,Na+ 不水解,因此c(Na+ )=0.002mol·L-1;
(4)根据物料守恒,因此有c(NH4+ )+c(NH3·H2O) =0.01mol·L-1;
(5)根据电荷守恒,c(Na+ )+c(H+ )+c(NH4+ )=c(OH-)+c(Cl-),c(H+ )+c(NH4+)-c(OH-) =c(Cl-)-c(Na+ )=0.008mol·L-1。


科目:高中化学 来源: 题型:
【题目】目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境。这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验。【实验Ⅰ】硫的质量确定

按图连接装置,检查好装置的气密性后,在硬质玻璃管A中放入1.00 g铁硫簇结构(含有部分不反应的杂质),在试管B中加入50.00 mL 0.1000 molL-1的酸性KMnO4溶液,在试管C中加入品红溶液。通入空气并加热,发现固体逐渐转变为红棕色。待固体完全转化后将B中溶液转移至250 mL容量瓶,洗涤试管B后定容。取25.00 mL该溶液用0.01000 molL-1的草酸(H2C2O4)进行测定剩余KMnO4溶液浓度的滴定。记录数据如下:
滴定次数 | 待测溶液体积/mL | 草酸溶液体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.50 | 23.70 |
2 | 25.00 | 1.02 | 26.03 |
3 | 25.00 | 0.00 | 24.99 |
相关反应:① 2MnO4- + 2H2O + 5SO2![]() 2Mn2+ + 5SO42- + 4H+
2Mn2+ + 5SO42- + 4H+
② 2MnO4- + 6H+ + 5H2C2O4![]() 2Mn2+ +10CO2↑+ 8H2O
2Mn2+ +10CO2↑+ 8H2O
【实验Ⅱ】铁的质量确定
将实验Ⅰ硬质玻璃管A中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经充分灼烧得0.600 g固体。
试回答下列问题:
(1)检查“实验Ⅰ”中装置气密性的方法是_______________。
(2)滴定终点的判断方法是______________。
(3)试管C中品红溶液的作用是_______________;有同学提出,撤去C装置,对实验没有影响,你的看法是___(选填“同意”或“不同意”),理由是________________。
(4)根据实验Ⅰ和实验Ⅱ中的数据可确定该铁硫簇结构的化学式为___________________。
【问题探究】
滴定过程中,细心的小明发现该KMnO4颜色褪去的速率较平常滴定时要快得多。为研究快的原因,甲同学继续进行了下列实验,实验数据如下表:
编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
1 | 25 | 5.0 | 2.0 | 40 |
2 | 25 | 5.0(另加少量可溶于水的MnSO4粉末) | 2.0 | 4 |
3 | 60 | 5.0 | 2.0 | 25 |
(5)分析上述数据,滴定过程中反应速率较快的原因可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,下列说法正确的是

A. 0-t1时,原电池的负极是铜片
B. 0-t1时,正极的电极反应式是2H++2e-=H2↑
C. t1时刻,电流方向发生变化的原因是Al 在浓硝酸中发生钝化,氧化膜阻止了Al进一步反应
D. tl时刻后,电子从铝经过导线流向铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】区别NaCl、FeCl3和NH4Cl三种溶液,可选用下列试剂中的( )
A.KSCN溶液 B.NaOH溶液 C.AgNO3溶液 D.BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 2.0gH218O与D2O的混合物中所含中子数为NA
B. 50mL18mol·L-1浓硫酸与足量铜供热,转移电子数为0.9NA
C. 0.1molCl2通入含0.1molFeBr2溶液中,被氧化的溴离子数为0.2NA
D. 标准状况下,2.24LNO和足量O2反应生成物中含有NO2分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吡格雷(clopigogrel)是一种用于抑制血小板聚集的药物,以![]() 为原料合成氟吡格雷的路线如下图:
为原料合成氟吡格雷的路线如下图:
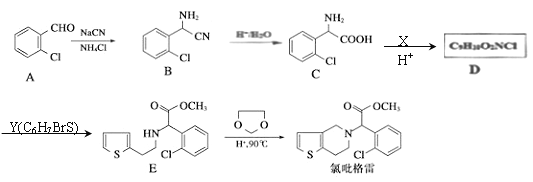
回答下列问题:
(1)A的名称为________________,D的结构简式为___________。
(2)化合物C在一定条件下可发生分子间成环反应生成含3个六元环的有机物,其化学方程式为_______。
(3)一定条件下,1分子Y与1分子HBr发生加成反应,生成的产物最多可能有__________种(不考虑立体异构);有E转化为F时,生成的另一种产物是______________。
(4)写出B的同分异构体中满足下列条件的任意一种有机物的结构简式_______________。
①含有两个-NH2的芳香族化合物;②核磁共振氢谱有3种吸收峰。
(5)结合上述流程写出以乙醇为有机物原料制备![]() 的合成路线流程图(无机试剂任选);_________________。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选);_________________。合成路线流程图示例如下:
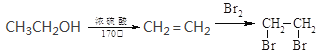
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016江苏卷】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊。 | 碳酸的酸性比苯酚的强 |
B | 室温下,向浓度均为0.1 mol·L–1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的氧化性比I2的强 |
D | 室温下,用pH试纸测得:0.1mol·L–1 Na2SO3溶液的pH约为10;0.1mol·L–1 NaHSO3溶液的pH约为5。 | HSO3–结合H+的能力比 SO32–的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各组物质中,物质之间不可能实现如图![]() 所示转化的是( )
所示转化的是( )
选项 | X | Y | Z | M |
A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
C | NH3(g) | NO | NO2 | O2 |
D | S(s) | SO2 | SO3 | O2 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com