

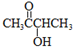 .
. CH3COO-+NH4++2Ag↓+3NH3+H2O.
CH3COO-+NH4++2Ag↓+3NH3+H2O. .
. .
. .
.分析 由于A分子中C、H、O三种元素的质量比为6:1:4可知C、H、O的物质的量之比为2:4:1;又由于A的质谱图中质荷比最大值为88,所以A的分子式为C4H8O2,根据分子式可知A中有一个不饱和度,又不能使Br2的CCl4溶液褪色,所以A中存在C=O键,再根据1mol B反应生成了2mol C,结合已知条件可推知A的结构为: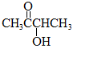 ,这样可以进一步推出B、C、D、E、F的结构简式,它们依次是:
,这样可以进一步推出B、C、D、E、F的结构简式,它们依次是: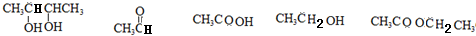 ,由于B与HBr发生取代反应生成卤代物,再在NaOH醇溶液中发生消去反应,且H分子中所有碳原子均在一条直线上,所以可以推得G和H的结构分别为:
,由于B与HBr发生取代反应生成卤代物,再在NaOH醇溶液中发生消去反应,且H分子中所有碳原子均在一条直线上,所以可以推得G和H的结构分别为: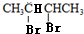 、
、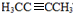 ,据此可以解题.
,据此可以解题.
解答 解:由于A分子中C、H、O三种元素的质量比为6:1:4可知C、H、O的物质的量之比为2:4:1;又由于A的质谱图中质荷比最大值为88,所以A的分子式为C4H8O2,根据分子式可知A中有一个不饱和度,又不能使Br2的CCl4溶液褪色,所以A中存在C=O键,再根据1mol B反应生成了2mol C,结合已知条件可推知A的结构为: ,这样可以进一步推出B、C、D、E、F的结构简式,它们依次是:
,这样可以进一步推出B、C、D、E、F的结构简式,它们依次是: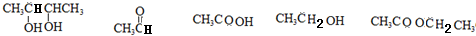 ,由于B与HBr发生取代反应生成卤代物,再在NaOH醇溶液中发生消去反应,且H分子中所有碳原子均在一条直线上,所以可以推得G和H的结构分别为:
,由于B与HBr发生取代反应生成卤代物,再在NaOH醇溶液中发生消去反应,且H分子中所有碳原子均在一条直线上,所以可以推得G和H的结构分别为: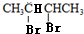 、
、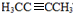 ,
,
(1)由上面的分析可知,A为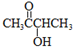 ,故答案为:
,故答案为: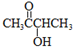 ;
;
(2)由A合成H的总产率应为①,②、③三步反应的产率之积,所以由A合成H的总产率=90.0%×82.0%×75.0%=55.4%,
故答案为:55.4%;
(3)D+E→F反应为乙酸与乙醇反应生成乙酸乙酯,反应类型为酯化反应,故答案为:酯化反应;
(4)由上面的分析可知,C为乙醛,它与银氨溶液反应的离子方程式为:CH3CHO+2[Ag(NH3)2]++2OH-  CH3COO-+NH4++2Ag↓+3NH3+H2O,
CH3COO-+NH4++2Ag↓+3NH3+H2O,
故答案为:CH3CHO+2[Ag(NH3)2]++2OH-  CH3COO-+NH4++2Ag↓+3NH3+H2O;
CH3COO-+NH4++2Ag↓+3NH3+H2O;
(5)若H分子中所有碳原子不在一条直线上,则H为1,3-丁二烯,H在一定条件下合成顺丁橡胶的化学方程式为 ,由于B是2,3-丁二醇,与HBr发生取代反应生成卤代物
,由于B是2,3-丁二醇,与HBr发生取代反应生成卤代物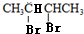 ,再在NaOH醇溶液中发生消去反应生成H,且H分子中所有碳原子均在一条直线上,所以可以推得G和H的结构,G为
,再在NaOH醇溶液中发生消去反应生成H,且H分子中所有碳原子均在一条直线上,所以可以推得G和H的结构,G为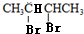 H为
H为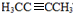 ,G转化为H的化学方程式为
,G转化为H的化学方程式为 ,
,
故答案为: ;
; ;
;
(6)A的结构为: ,根据条件:a.X核磁共振氢谱有3个峰,峰面积之比为1:1:2,即X有三种位置的氢,且个数之比为1:1:2,b.1mol X可在HIO4加热的条件下反应,可形成1mol 二元醛,根据信息可知X应为含有两个羟基的环状物,c.1mol X最多能与2mol Na反应,说明X有2个羟基,d.X不与NaHCO3反应,也不与NaOH反应,也不与Br2发生加成反应,说明有X没有羧基,不含有碳碳双键,则X的结构为
,根据条件:a.X核磁共振氢谱有3个峰,峰面积之比为1:1:2,即X有三种位置的氢,且个数之比为1:1:2,b.1mol X可在HIO4加热的条件下反应,可形成1mol 二元醛,根据信息可知X应为含有两个羟基的环状物,c.1mol X最多能与2mol Na反应,说明X有2个羟基,d.X不与NaHCO3反应,也不与NaOH反应,也不与Br2发生加成反应,说明有X没有羧基,不含有碳碳双键,则X的结构为 ,
,
故答案为: .
.
点评 本题考查了有机官能团的性质、有机结构的推断、有机反应类型、同分异构体的书写等知识,中等难度,解题的难点在第(6)小问,写有条件的同分异构体,对学生掌握有机结构特点及从题中获取信息并灵活运用能力要求较高.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  除去CO中的CO2 | |
| B. |  苯萃取碘水中的I2分出水层后的操作 | |
| C. |  配制0.10mol•L-1 NaOH溶液 | |
| D. |  记录滴定终点读数为12.20mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com