
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如下图所示。下列判断正确的是
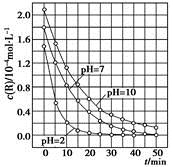
A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等
B.溶液酸性越强,R的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)1.1中和反应反应热的测定(解析版) 题型:选择题
用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH溶液反应,实验中测得起始温度为20.1 ℃,终止温度为23.4 ℃,反应后溶液的比热容为4.18 J·g-1·℃-1,盐酸和NaOH溶液的密度都近似认为是1 g·cm-3,则中和反应生成1 mol 水时放热( )
A.55.2 kJ B.391 kJ C.336 kJ D.1.38 kJ
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学铁及其化合物主要性质(解析版) 题型:选择题
FeSO4可发生如图所示的一系列反应,下列说法错误的是

A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用做净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学金属矿物、海水、煤、石油、天然气开发利用(解析版) 题型:选择题
化学在生产和日常生活中有着重要的应用。下列叙述正确的是
A.在有机化工中,氯气是合成塑料、橡胶、人造纤维、农药、染料和药品的重要原料
B.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料
C.白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去
D.汽车尾气中含有氮的氧化物,是汽油不完全燃烧造成的
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学速率表示与平衡移动(解析版) 题型:选择题
为了变废为宝,控制温室效应,工业上可用CO2来生产甲醇。一定条件下发生如下反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是
CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是
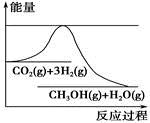
A.降低温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来
D.再充入1 mol CO2和3 mol H2
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习5(解析版) 题型:填空题
氧元素与多种元素具有亲和力,所形成化合物的种类仅次于碳元素。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为 ,氧元素与氟元素能形成OF2分子,该分子的空间构型为 。
(2)根据等电子原理,判断NO2+离子中,氮原子轨道的杂化类型为 ,1molO22+所含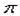 键的数目为 。
键的数目为 。
(3)氧元素与过渡元素可以形成多种价态的金属氧化物。如铬可生成Cr2O3、CrO3等,试写出Cr3+核外电子排式 。
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:
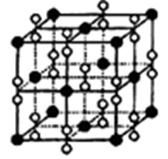
由此可判断该钙的氧化物的化学式为 。已知晶胞边长为540pm,则该氧化物的密度是 g·cm-3。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习4(解析版) 题型:填空题
下图为某药物合成路线的一部分。
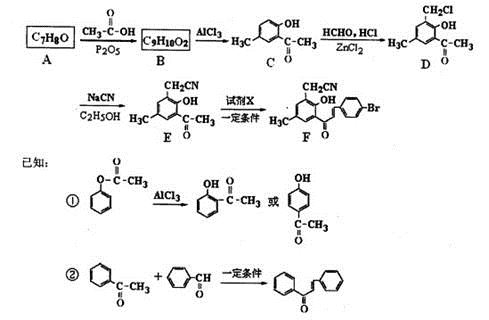
(1)A→B的化学方程式为 ,E中的含氧官能团名称为 、 。
(2)若②的反应历程经历了中间产物 ,则该反应历程先后经历的反应类型为 、 。试剂X的结构简式为 。
,则该反应历程先后经历的反应类型为 、 。试剂X的结构简式为 。
(3)写出两种满足下列要求的D的同分异构体的结构简式 , 。
①分子中有4种化学环境不同的氢原子;
②可发生水解反应,一种产物可发生银镜反应,另一种能与FeCl3发生显色反应;
③分子中的氯原子不与苯环直接相连。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习2(解析版) 题型:填空题
氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示

请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是 、 ;
(2)基态B原子的电子排布式为 ;B和N相比,电负性较大的是
,BN中B元素的化合价为 ;
(3)在BF3分子中,F-B-F的键角是 ,B原子的杂化轨道类型为
,BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为 ;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为 ,层间作用力为 ;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有 个氮原子、 个硼原子,立方氮化硼的密度是 g?cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子方程式的书写及正误判断(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+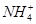 +
+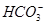 =BaCO3↓+NH3·H2O+H2O
=BaCO3↓+NH3·H2O+H2O
B.氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+=Fe3++3H2O
C.向亚硫酸钠溶液中加入足量硝酸: +2H+=SO2↑+H2O
+2H+=SO2↑+H2O
D.向AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH↓+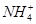
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com