
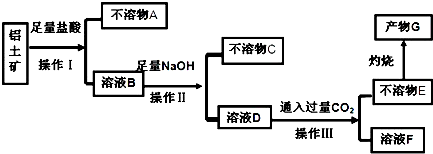
分析 铝土矿的主要成分是Al2O3,含SiO2、Fe2O3等杂质,由流程可知,加足量盐酸过滤得到不溶物A为SiO2,溶液B中含Al3+、Fe3+,加过量NaOH溶液过滤得到不溶物C为Fe(OH)3,溶液D中含偏铝酸根离子,通入过量二氧化碳后过滤得到不溶物E为Al(OH)3,G为氧化铝,溶液F中含碳酸氢钠,以此来解答.
解答 解:铝土矿的主要成分是Al2O3,含SiO2、Fe2O3等杂质,由流程可知,加足量盐酸过滤得到不溶物A为SiO2,溶液B中含Al3+、Fe3+,加过量NaOH溶液过滤得到不溶物B为Fe(OH)3,溶液D中含偏铝酸根离子,通入过量二氧化碳后过滤得到不溶物E为Al(OH)3,G为氧化铝,溶液F中含碳酸氢钠,
(1)由上述分析可知,操作Ⅰ、Ⅱ、Ⅲ的名称均为过滤,故答案为:过滤;
(2)不溶物C是Fe(OH)3,不溶物E是Al(OH)3,B→D反应的离子方程式:Al3++4OH-=AlO2-+2H2O,故答案为:Fe(OH)3;Al(OH)3;Al3++4OH-=AlO2-+2H2O;
(3)溶液F中含碳酸氢钠,可作发酵粉或治疗胃酸的药物等,故答案为:作发酵粉或治疗胃酸的药物.
点评 本题考查物质的分离、提纯的方法及基本操作的综合应用,为高频考点,把握流程中物质的性质、发生的反应、混合物分离方法为解答的关键,侧重分析、推断及实验能力的综合考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 表示的分子式C6H14结构简式(CH3)2CHCH2CH2CH3名称是2-甲基戊烷.
表示的分子式C6H14结构简式(CH3)2CHCH2CH2CH3名称是2-甲基戊烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 当溶液的pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3•H2O)>c(CO32-) | |
| B. | NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3•H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3) | |
| C. | 往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小 | |
| D. | 通过分析可知常温下Kb(NH3•H2O)>Ka1(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY3一定是离子化合物 | |
| B. | 若Y的原子序数为m,X的原子序数一定是m±4 | |
| C. | X和Y可属同一周期,也可属于两个不同周期 | |
| D. | XY3一定不属于同一主族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com