
密度为ρ g/cm3的溶液V mL,含有相对分子质量为M的溶质m g,其物质的量浓度为c mol/L,质量分数为w%,下列表示式错误的是( )
A.c= B.
B. m=
m= C.ρ=
C.ρ= D.w%=
D.w%= %
%
科目:高中化学 来源:2017届安徽省安庆市等六校高三第一次联考化学试卷(解析版) 题型:选择题
观察下列有关实验装置,相关评价错误的是( )
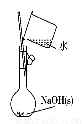
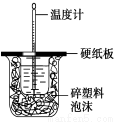
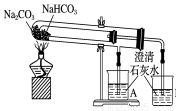

图(1) 图(2) 图(3) 图(4)
A.图(1)用于配制0.10 mol·L-1 NaOH溶液;评价:正确
B.图(2)用于测定中和热;评价:错误,装置中缺少了环形玻璃搅拌棒
C.图(3)用于比较Na2CO3、NaHCO3的热稳定性;评价:正确
D.图(4)证明铁发生吸氧腐蚀时空气参加反应;评价:正确
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨师大附中高二上期中化学卷(解析版) 题型:选择题
有溶质的物质的量浓度均为0.1 mol/L的下列八种溶液①HCl ②H2SO4 ③CH3COOH ④Ba(OH)2 ⑤KOH ⑥NaF ⑦KCl ⑧NH4Cl 这些溶液的pH由小到大的顺序是
A.②①③⑧⑦⑥⑤④ B.②①③⑥⑦⑧⑤④
C.①②③⑧⑦⑥④⑤ D.②①⑧③⑦⑥④⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨六中高一上期中化学试卷(解析版) 题型:填空题
按要求回答问题
(1)NaHSO4与NaHCO3溶液反应 。
(2)KClO3+6HCl=KCl+3Cl2↑+3H2O氧化剂与还原剂的物质的量的比为 。氧化产物与还原产物的物质的量的比 。
(3)已知下面三个反应:2Fe2++Cl2=2Fe3++2Cl- ;2Fe2++Br2=2Fe3++2Br-; 2Br-+Cl2=Br2+2Cl-
①根据以上三个反应,判断还原剂的还原性由强到弱的顺序 。
②写出氯气和溴化亚铁以物质的量之比为3:4的离子反应方程式 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨六中高一上期中化学试卷(解析版) 题型:选择题
下列关于金属元素的特征叙述,正确的是( )
)
A.金属元素的原子 只有还原性、金属离子只有氧化性
只有还原性、金属离子只有氧化性
B.金属元素在化合物中一定显正价
C.金属元素在不同化合物中的化合价都相同
D.金属元素的单质在常温下都呈固态
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨六中高一上期中化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是( )
A.向浑浊石灰水中加入盐酸:OH-+H+=H2O
B.硫酸与氢氧化钡溶液反应:Ba2++OH-+SO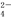 +H+=BaSO4↓+H2O
+H+=BaSO4↓+H2O
C.碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
D.碳酸氢钙与过量的NaOH溶液反应:Ca2++2HCO +2OH-=CaCO3↓+2H2O+CO
+2OH-=CaCO3↓+2H2O+CO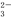
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨六中高一上期中化学试卷(解析版) 题型:选择题
下列各组物质中,分子数相同的是( )
A.5 L Cl2与5 L HCl B.36 g H2O与44.8 L CO2
C.25 ℃,1.01×105 Pa时,等体积的空气与H2 D.0.2 mol O2与标准状况下2.24 L水
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨六中高二上期中化学试卷(解析版) 题型:选择题
c(H+)相同的盐酸溶液和醋酸溶液分别与 锌反应,若最后锌都己完全溶解,但放出的气体一样多,则下列判断正确的是( )
锌反应,若最后锌都己完全溶解,但放出的气体一样多,则下列判断正确的是( )
A.整个反应阶段平均速率:醋酸>盐酸 B.反应所需时间:醋酸>盐酸
C.参加反应的锌质量:盐酸>醋酸 D.开始,反应速率:盐酸>醋酸
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆中学高二上期中化学试卷(解析版) 题型:填空题
甲烷广泛存在于天然气、沼气、煤矿坑气之中,是优质的气体燃料,更是制造许多化工产品的重要原料。
Ⅰ.制取氢气
已知:CH4(g)+H2O(g) CO(g)+3H2(g) △H=+206.2kJ·mol-1
CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g) 2CO(g)+2H2(g) △H=+247.4kJ·mol-1
2CO(g)+2H2(g) △H=+247.4kJ·mol-1
(1)请写出CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式___________________
(2)若将0.1mol CH4和0.1mol H2O(g)通入体积为10L的密闭容器里,在一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g),CH4的平衡转化率与温度、压强的关系如图
CO(g)+3H2(g),CH4的平衡转化率与温度、压强的关系如图
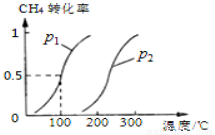
①已知1 00℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率_________;
00℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率_________;
②该反应的化学平衡常数___________________;
③图中的p1 p2(填“<”、“>”或“=”);
Ⅱ.制备甲醇
(3)在压强为0.1MPa条件下,将a mol CO与3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g) △H<0。若容器容积不变,下列措施可增加甲醇产率的是________;
CH3OH(g) △H<0。若容器容积不变,下列措施可增加甲醇产率的是________;
A.升高温度
B.再充入1mol CO和3mol H2
C.将CH3OH(g)从体系中分离
D.充入He,使体系总压强增大
E.使用更高效的催化剂
Ⅲ.合成乙酸
(4)甲烷直接合成乙酸具有重要的理论意义和应用价值。光催化反应技术使用CH4和 (填化学式)直接合成乙酸,且符合“绿色化学”的要求(原子利用率100℅)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com