
【题目】利用如图装置测定中和热的实验步骤如下: ①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol): .
(2)倒入NaOH溶液的正确操作是(从下列选出).
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是(从下列选出).
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) . a.实验装置保温、隔热效果差b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
【答案】
(1)NaOH(aq)+ ![]() H2SO4(aq)=
H2SO4(aq)= ![]() Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol
Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol
(2)C
(3)D
(4)acd
【解析】解:(1)中和热数值为57.3kJ/mol,反应放热,则中和热的热化学方程式:NaOH(aq)+ ![]() H2SO4(aq)=
H2SO4(aq)= ![]() Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol; 所以答案是:NaOH(aq)+
Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol; 所以答案是:NaOH(aq)+ ![]() H2SO4(aq)=
H2SO4(aq)= ![]() Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol;(2)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,
Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol;(2)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,
所以答案是:C;(3)用套在温度计上的环形玻璃棒轻轻地搅动使硫酸与NaOH溶液混合均匀,故选D;(4)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;b.量取NaOH溶液的体积时仰视读数,放出的热量偏高,中和热的数值偏大,故b错误;c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,故c正确;d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确;所以答案是:acd.


科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)根据分子中所含官能团可预测有机化合物的性质. ①下列化合物中能发生消去反应的是(填字母).
a.CH3OH b.CH3CH2Cl c.CH3CH2OH d. 
②下列化合物中,常温下易被空气氧化的是(填字母).
(2)甲苯( ![]() )是一种重要的有机化工原料. ①甲苯分子中一定共平面的碳原子有个.
)是一种重要的有机化工原料. ①甲苯分子中一定共平面的碳原子有个.
②甲苯苯环上的一溴代物有种,请写出其中一种的结构简式 .
③除去苯中混有的少量甲苯,可选用的试剂是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的装置如图: 
(1)实验室制取氯气的化学方程式为:MnO2+4HCl(浓)=MnCl2++2H2O;氧化剂
(2)实验室通常用饱和食盐水吸收杂质 , B瓶盛装的试剂是
(3)C装置吸收氯气用 , 反应的化学方程式为
(4)检验氯气是否泄漏用湿的试纸,若泄漏试纸变色.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用高岭土(主要成分为A12 O3、SiO2和Fe2O3)为原料制备水质净化剂PAC{[A12(OH)nC16﹣n]m(n<6,m为聚合度)}的过程如图.下列说法正确的是( ) 
A.试剂X为H2SO4
B.滤渣主要成分为Fe(OH)3、H2 SiO3
C.调pH过高或过低均会减少PAC生成
D.滤液浓缩聚合过程发生了加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈佛大学A.Y.Liu教授首次合成类金刚石相氮化碳(β﹣﹣C3N4).福州大学王新晨教授在此基础上以单氰胺(CH2N2)为原料制得光催化剂类石墨相氮化碳(g﹣C3N4),其单层结构如图a, 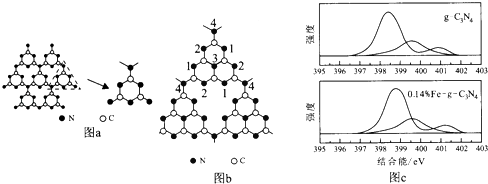
(1)C,H,N元素电负性从大到小的顺序为(填元素符号).
(2)β﹣﹣C3N4熔点、硬度均高于金刚石,其原因为 .
(3)β﹣﹣C3N4和g﹣﹣C3N4中碳原子的杂化轨道类型分别为 .
(4)单氰胺的结构式为 .
(5)g﹣﹣C3N4中存在的作用力为(填序号).
a.离子键 b.σ键 c.π键 d.氢键 e.范德华力
(6)g﹣﹣C3N4中掺杂少量铁元素能提高光催化效果.图b为g﹣﹣C3N4的另一种单层结构;图c为Fe3+掺杂前后N﹣1s谱图(N原子1s的XPS谱图,图中峰的强度正比于原子数目),图c中横坐标为g﹣﹣C3N4中N﹣1s结合能(原子结合能与稳定性成正比),掺杂Fe3+后,结合能最小的谱线发生了明显右移.
①Fe3+的价电子轨道表示式为 .
②发生位移的谱线对应的N原子为(填图b中的序号).
③谱线右移的原因为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别.线路①、②、③是工业生产硝酸的主要途径,线路Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径.
(1)写出①步反应的化学方程式: .
(2)下列环境问题与NO2的排放有关的是(填字母序号).
A.赤潮
B.光化学烟雾
C.臭氧空洞
D.温室效应
E.酸雨
(3)若将12.8g铜跟一定量的浓硝酸反应,铜消耗完时,共产生气体5.6L(标准状况),则所消耗的硝酸的物质的量是 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽徳罗常数的值,下列说法不正确的是( )
A.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
B.常温常压下的67.2L氯气与27g铝充分反应,转移电子数为3NA
C.1L 1mol/L的稀硝酸中,含氧原子数为3NA
D.1molCO和CO2混合气体中含C原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数值.下列有关叙述正确的是( )
A.0.5mol/L碳酸钠溶液中含有lmolNa+
B.14g氮气和一氧化碳混合气体中含原子总数为NA
C.标准状况下,2.24LCCl4物质的量为0.1mol
D.56g铁溶于过量的盐酸,电子转移数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com