
【题目】硫代硫醉钠又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂.硫代硫酸钠(Na2S203)可由亚硫酸钠和硫粉通过化合反应制得,装置如图I所示.
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图2所示.
(1)Na2S2O35H2O的制备:
步骤1:如图连接好装置后(未装药品),检查A、C装且气密性的操作是_ .
步骤2:加人药品,打开K1、关闭K2、加热.装置B、D中的药品可选用下列物质中的(填编号).
A.NaOH溶液 B.浓H2SO4C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的最逐渐减少.
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液过滤、洗涤、烘干,得到产品.
(2)Na2S2O3性质的检验:向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式 .
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加人足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解.此时Cr42﹣全部转化为Cr2O72﹣;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010molL﹣1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00mL.部分反应的离子方程式为:Cr2O72﹣+6I﹣+14H+═2Cr3++3I2+7H2O.I2+2S2O32﹣═S4O62﹣+2I﹣ , 则该废水中Ba2+的物质的量浓度为 .
【答案】
(1)关闭K2打开K1 , 在D中加水淹没导管末端,用热毛巾或双手捂住烧瓶,D中导管有气泡冒出,冷却后形成1段水柱,说明气密性良好;ACD;冷却结晶
(2)Na2S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl
(3)0.0024mol/L
【解析】解:(1)步骤1:利用气体热胀冷缩性质,检验装置气密性,具体操作为:关闭K2打开K1 , 在D中加水淹没导管末端,用热毛巾或双手捂住烧瓶,D中导管有气泡冒出,冷却后形成1段水柱,说明气密性良好,
故答案为:关闭K2打开K1 , 在D中加水淹没导管末端,用热毛巾或双手捂住烧瓶,D中导管有气泡冒出,冷却后形成1段水柱,说明气密性良好;
步骤2:装置B、D的作用是进行尾气处理,防止尾气中二氧化硫污染空气,二氧化硫具有还原性,可以用酸性高锰酸钾溶液氧化吸收,二氧化硫能与氢氧化钠溶液、碳酸氢钠溶液反应被吸收,故选:ACD;
步骤3:硫代硫酸钠在酸性溶液中不稳定,应控制溶液为弱碱性,可以控制溶液pH接近或不小于7,
步骤4:从溶液中获得晶体,需要加热浓缩,趁热过滤,再将滤液冷却结晶、过滤、洗涤、烘干,得到产品,
故答案为:冷却结晶;(2)由题目信息可知,Na2S2O3被氯水氧化反应生成Na2SO4、H2SO4 , 氯气被还原为HCl,反应方程式为:Na2 S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl,
故答案为:Na2S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl;(3)由题意可知,BaCrO4用盐酸溶解转化为Cr2O2﹣7 , 由元素守恒及已知方程式可得关系式:2Ba2+~2BaCrO4~Cr2O2﹣7~3I2~6Na2S2O3 , 消耗的Na2S2O3为0.018L×0.01mol/L,则n(Ba2+)=0.018L×0.01mol/L× ![]() =0.00006mol,故溶液中c(Ba2+)=
=0.00006mol,故溶液中c(Ba2+)= ![]() =0.0024mol/L,
=0.0024mol/L,
故答案为:0.0024mol/L.
(1)步骤1:利用气体热胀冷缩性质,检验装置气密性;
步骤2:装置B、D的作用是进行尾气处理,防止尾气中二氧化硫污染空气;
步骤3:硫代硫酸钠在酸性溶液中不稳定,应控制溶液为弱碱性,即控制溶液pH接近或不小于7;
步骤4:从溶液中获得晶体,需要加热浓缩,趁热过滤,再将滤液冷却结晶、过滤、洗涤、烘干,得到产品;(2)由题目信息可知,Na2S2O3被氯水氧化反应生成Na2SO4、H2SO4 , 氯气被还原为HCl;(3)由题意可知,BaCrO4用盐酸溶解转化为Cr2O2﹣7 , 由元素守恒及已知方程式可得关系式:2Ba2+~2BaCrO4~Cr2O2﹣7~3I2~6Na2S2O3 , 结合消耗的Na2S2O3利用关系式计算溶液中n(Ba2+),进而计算c(Ba2+).


科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验:
甲同学向1 mol·L1氯化铁溶液中加入少量的NaOH溶液;
乙同学直接加热饱和FeCl3溶液;
丙同学向25 mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
(1)其中能得到Fe(OH)3胶体的同学是 。
(2)证明有Fe(OH)3胶体生成的实验操作是 。
(3)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶粒带 电荷(填“正”或“负”)。
②向其中加入饱和Na2SO4溶液,产生的现象是 。
(4)Fe(OH)3胶体能稳定存在的主要原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列获取物质的方法,不正确的是( )
A.用电石和饱和食盐水制取乙炔
B.通过石油分馏得到甲烷、乙烯和苯
C.用碳酸钠和氢氧化钙反应制氢氧化钠
D.将氯气通入氢氧化钠溶液得到漂白液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( ) 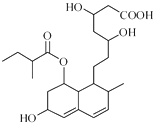
A.不能通过反应形成高分子化合物
B.不能使酸性KMnO4溶液褪色
C.能发生加成、取代、消去反应
D.1mol该物质最多可与1mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 若H2O2分解产生1mol O2,理论上转移的电子数约为4NA
B. 1.8g的NH4+离子中含有的电子数为0.11 NA
C. 通常条件下,11.2L氧气中所含有的原子数为NA
D. 通常条件下,10.0mL水中所含分子数约为0.556NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)现有NaOH、Na2CO3、Ba(OH)2三种无色溶液,选用一种试剂把他们鉴别出来,并写出反应的离子方程式。
①鉴别试剂____________;
②反应的离子方程式__________________、________________、________________。
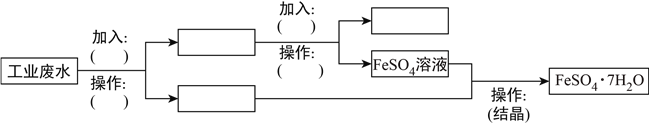
(2)某工厂的废水中含有大量的FeSO4、较多的Cu2+和少量Na+。为了减少污染并变废为宝,工厂计划从该废水中回收FeSO4和Cu。请根据流程图,在方框和括号内填写物质的名称(或主要成分的化学式)或操作方法,完成回收FeSO4和Cu的简单实验方案。_____________、_____________、_____________、_____________、_____________、_____________、_____________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在碱性溶液中能大量共存且溶液为无色透明的离子组是
A. K+ 、MnO4-、Na+、Cl- B. K+、Na+、NO3-、CO32-
C. Na+、H+、NO3-、SO42- D. Fe3+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
A.CO2是氧化产物
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.ClO2作水处理剂时,利用了其强氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com