
| m |
| M |
| n |
| V |
| 6.99g |
| 233g/mol |
| 0.03mol |
| 0.01L |
| 0.01mol |
| 0.01L |


科目:高中化学 来源: 题型:
| A、0.6mol |
| B、1mol |
| C、0.8mol |
| D、1.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Mg+CO2
| ||||
| B、Mg(OH)2+2HCl=MgCl2+2H2O | ||||
C、2Al+Fe2O3
| ||||
D、H2+CuO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,8.8g CO2和N2O混合气体中所含的电子数为4.4NA |
| B、5.6 g铁与500 mL 2 mol?L-1硝酸反应,转移的电子数为0.2NA |
| C、常温常压下,0.4 mol Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA |
| D、V La mol?L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
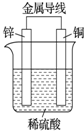
| A、溶液中H+向Zn电极移动 |
| B、外电路中电流方向为:Cu→Zn |
| C、负极上的电极反应:Zn-2e-═Zn2+ |
| D、有1 mol电子流过导线,则Cu电极上产生的H2为11.2 L(标准状况) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com