
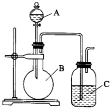
 某同学设计如图装置,探究非金属性质变化规律.
某同学设计如图装置,探究非金属性质变化规律.分析 (1)根据强酸能制弱酸的规律结合硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:酸性:HNO3>H2CO3>H2SiO3;
(2)利用如图装置证明氯气氧化性强于碘单质的氧化性,C中发生的是氯气和碘离子的反应生成碘单质,碘单质遇淀粉变蓝;生成的氯气有毒需要尾气吸收;
(3)A中装浓盐酸,B中装高锰酸钾溶液反应生成氯气具有氧化性,通入饱和氢硫酸溶液,反应开始后观察现象是C中产生淡黄色沉淀,说明氯气氧化硫化氢为硫单质;单质氧化剂的氧化性大于氧化产物,判断非金属性.
解答 解:(1)①现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:酸性:HNO3>H2CO3>H2SiO3,根据强酸制取弱酸知,A中试剂是硝酸、B中物质是碳酸钙,
故答案为:硝酸;碳酸钙;
②硝酸和碳酸钙反应生成二氧化碳,二氧化碳通入硅酸钠溶液生成硅酸沉淀,装置C中反应是:CO2+SiO32-+H2O=H2SiO3↓+CO32-;
故答案为:CO2+SiO32-+H2O=H2SiO3↓+CO32-;
③硝酸易挥发,硝酸进入C中与硅酸钠反应生成硅酸,所以不能确定C中反应物时二氧化碳还是硝酸;
故答案为:硝酸易挥发,硝酸进入C中与硅酸钠反应生成硅酸;
(2)①利用如图装置证明氯气氧化性强于碘单质的氧化性,C中发生的是氯气和碘离子的反应生成碘单质,碘单质遇淀粉变蓝,所以C中加入淀粉碘化钾,
故答案为:淀粉碘化钾;
②B中发生的反应为2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,C中离子方程式为2I-+Cl2═I2+2Cl-,
故答案为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O;2I-+Cl2═I2+2Cl-;
③生成的氯气有毒需要尾气吸收,在C后加成氢氧化钠溶液的烧杯吸收氯气;
故答案为:增加装有氢氧化钠溶液的尾气吸收装置;
(3)如果C中装饱和氢硫酸溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察现象是C中产生淡黄色沉淀,反应的化学方程式为:Cl2+H2S═S↓+2HCl;证明氯元素比硫元素非金属性强,
故答案为:Cl2+H2S═S↓+2HCl;能.
点评 本题考查性质实验方案设计,为高频考点,侧重于考查学生的实验设计能力和对基础知识的应用能力,明确物质性质及实验操作规范性是解本题关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 通常状况下,1mol/L Na2CO3溶液中含钠离子数为2NA | |
| B. | 4℃时,18g 2H216O中含有共用电子对数为2NA | |
| C. | 1mol N5+含有的电子数为34NA | |
| D. | 1mol NH4+中含有的中子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有NaHCO3 | B. | 一定含有K2CO3 | C. | 可能含有NaHCO3 | D. | 一定含有NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 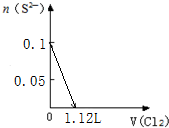 | B. | 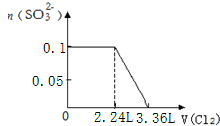 | ||
| C. | 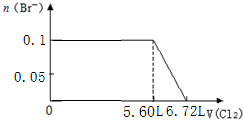 | D. | 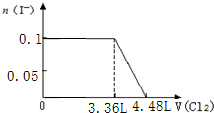 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
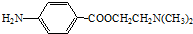 )可用作临床麻醉剂,熔点约60℃.它的一条合成路线如下图所示(部分反应试剂和条件已省略):
)可用作临床麻醉剂,熔点约60℃.它的一条合成路线如下图所示(部分反应试剂和条件已省略):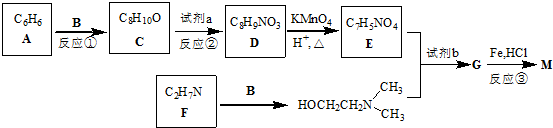
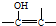 的结构不稳定.
的结构不稳定.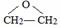 FH3C-NH-CH3
FH3C-NH-CH3 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用地沟油制肥皂的实验中,可以用玻璃棒蘸取反应液滴入有热水的试管中,振荡,若无油滴浮在液面上,说明反应液中的地沟油已完全皂化 | |
| B. | 制备硝基苯,混合药品的先后顺序为:向试管中先加入苯,再加入浓硫酸,最后加入浓硝酸 | |
| C. | 除去溴乙烷中的少量溴:加入Na2SO3溶液,振荡,静置分层后,除去水层 | |
| D. | 实验室受酸腐蚀时的处理:先用大量水冲洗,再用饱和碳酸氢钠溶液或肥皂水洗,最后再用水冲洗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com