
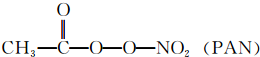 等二次污染物.
等二次污染物.分析 (1)As原子核外电子数为33,根据能量最低原理书写核外电子排布式;
(2)Fe3+可以空轨道,CN-含有孤对电子,二者形成配位键;与CN-互为等电子体的化合物含有2个原子、价电子总数为10;
(3)①N2O结构式可表示为N═N═O,N2O中中心N原子形成2个σ键、没有孤对电子,杂化轨道数目为2;
单键为σ键,双键含有1个σ键、1个π键,PAN分子中σ键数目为10;
②Kr晶体为面心立方晶体,以顶点Kr原子研究,与之相邻的Kr原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,利用均摊法计算晶胞中Kr原子数目、晶胞中Kr原子配位数,结合晶胞中含有Kr原子数目,表示出晶胞质量,再结合m=ρV计算晶胞棱长.
解答 解:(1)As原子核外电子数为33,根据能量最低原理,核外电子排布式为:1s22s22p63s23p63d104s24p3,
故答案为:1s22s22p63s23p63d104s24p3;
(2)Fe3+含有空轨道,CN-含有孤对电子,二者之间形成配位键;原子数目相等、价电子数目相等的微粒互为等电子体,与CN-互为等电子体的化合物分子式为CO,
故答案为:配位;CO;
(3)①N2O结构式可表示为N=N=O,N2O中中心氮原子形成2个σ键、没有孤对电子,杂化轨道数目为2,N原子采取sp杂化;单键为σ键,双键含有1个σ键、1个π键,PAN分子中σ键数目为10,则l mol PAN中含σ键数目为10NA,
故答案为:sp;10NA;
②Kr晶体为面心立方晶体,以顶点Kr原子研究,与之相邻的Kr原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,晶体中与每个Kr原子相紧邻的Kr原子数为$\frac{3×8}{2}$=12,晶胞中Kr原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则$\frac{m}{n}$=3;
晶胞质量为4×$\frac{M}{{N}_{A}}$g,晶体的密度为ρg/cm3,则ρg/cm3×(a×10-7 cm)3=4×$\frac{M}{{N}_{A}}$g,解得a=$\root{3}{\frac{4M}{ρ{N}_{A}}}$×10-7,
故答案为:3;$\root{3}{\frac{4M}{ρ{N}_{A}}}$×10-7.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、配合物、等电子体、杂化方式、化学键、晶胞计算等,是都物质结构主干知识考查,(3)中计算需要学生具备一定的空间想象,理解掌握用均摊法进行晶胞有关计算.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 将铝丝放入浓硫酸中 | 无明显现象 | 铝丝发生了钝化 |
| B | 将SO2通入过量的Na2CO3溶液中,将产生的气体再通入Na2SiO3溶液中 | 有白色沉淀生成 | 证明酸性:H2SO3>H2CO3>H2SiO3 |
| C | 向含有Fe3+的溶液中滴加KSCN溶液 | 溶液变红色 | 有Fe(SCN)3生成 |
| D | 向KOH溶液中滴加足量的MgSO4溶液,然后再滴加足量的FeCl3溶液 | 先产生白色沉淀,然后沉淀变红褐色 | Ksp[Fe(OH)3]>Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
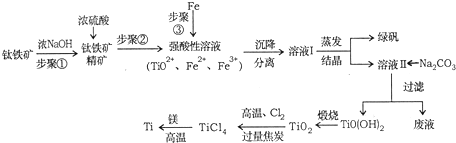
| PH | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | TiO(OH)2 |
| 开始沉淀 | 1.1 | 4.5 | 7 | 1 |
| 完全沉淀 | 2.8 | 6.4 | 9.2 | 2.7 |
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C57H104O6 | B. | C57H108O6 | C. | C57H106O6 | D. | C57H102O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
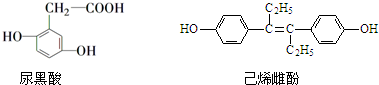
| A. | 尿黑酸分子中所有碳原子一定都在同一平面内 | |
| B. | 己烯雌酚可发生加成、取代、氧化、加聚、酯化反应 | |
| C. | 尿黑酸和己烯雌酚都属于芳香族化合物 | |
| D. | 各1mol的尿黑酸和己烯雌酚分别最多能消耗3mol 和6mol Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
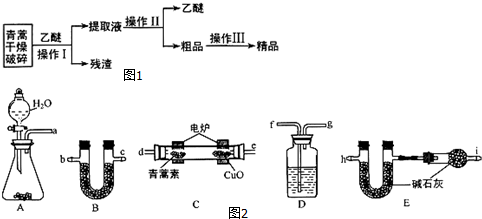
| 装置质量 | 实验前/g | 实验后/g |
| B | 22.6 | 42.4 |
| E(不含干燥管) | 80.2 | 146.2 |
查看答案和解析>>
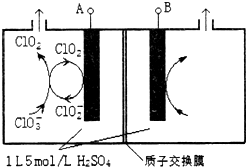
科目:高中化学 来源: 题型:选择题
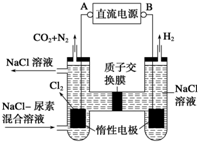
| A. | A 极为电源的负极 | |
| B. | 阳极室中发生的反应只有CO(NH2)2-6e-+6OH -=N2↑+CO2↑+5H2O | |
| C. | 阴极室溶液的 PH 电解前后保持不变 | |
| D. | 除去 3.6 克尿素时阴极一定生成 H26.72L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
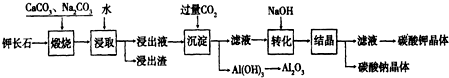
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com