
【题目】有的同学根据组成或性质将Na2CO3、NaOH、NaCl划分为一类。下列选项中的物质根据分类依据(后者是分类依据)能与上述三种物质归为一类的是
A.NaNO3(都属于钠盐)B.CuSO4(都易溶于水)
C.KNO3(都能与AgNO3溶液反应)D.KMnO4(固态时均为白色)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定能大量共存的是
A. NH4+、SO42-、CO32-、K+ B. Na+、Ba2+、Ca2+、HCO3-
C. Mg2+、SO42-、K+、Cl- D. K+、Cl-、Na+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表数据是对应物质的熔点:
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
物质 | Na2O | NaCl | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
熔点℃ | 920 | 801 | 1291 | 160 | -107 | 2072 | -57 | 1723 |
(1)上述涉及原子中最活泼非金属原子核外电子排布式是________________;某阴离子的轨道表示式为![]() ,其核外电子占有的轨道总数是_____个,有______种能量不同的电子,有_____种不同运动状态的电子。
,其核外电子占有的轨道总数是_____个,有______种能量不同的电子,有_____种不同运动状态的电子。
(2)物质①的电子式:____________,⑦的结构式:_______________。
(3)④溶于水溶液呈酸性,用离子方程式表示其原因_______________________________;若把其溶液加热蒸干并灼烧,得到的固体是_______________。
(4)不能用于比较Na与Al金属性相对强弱的事实是_________________。
A.最高价氧化物对应水化物的碱性 B.Na最外层1个电子而Al 最外层3个电子
C.单质与H2O反应的难易程度 D.比较同浓度NaCl和AlCl3的pH值
(5)⑧比⑦熔点高出很多,其理由是:_____________________________;①和②都属于离子晶体,但①比②的熔点高,请解释原因____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学式为![]() 的配合物的说法中正确的是
的配合物的说法中正确的是![]()
![]()
A. 配体是![]() 和
和![]() ,配位数是9
,配位数是9
B. 中心离子是![]() ,配离子是
,配离子是![]()
C. 内界和外界中的![]() 的数目比是2:1
的数目比是2:1
D. 加入足量![]() 溶液,所有
溶液,所有![]() 均被完全沉淀
均被完全沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() 。以互为同系物的单取代芳香烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的单取代芳香烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
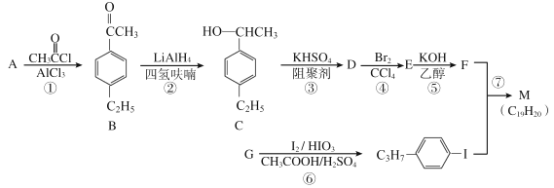
已知: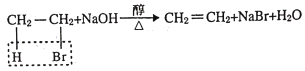
回答下列问题:
(1)A的结构简式为_______;G的分子式为_______。
(2)D中含有的官能团名称是______________。
(3)反应①的反应类型是________,反应④的反应类型是___________。
(4)反应⑤的化学方程式为____________________________。
(5)能同时满足下列条件的B的同分异构体有______种(不考虑立体异构),其中核磁共振氢谱为5组峰,且峰面积之比为6:2:2:1:1的是_________(写结构简式)。
①苯环上有两个取代基 ②能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大。元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数之比为3∶8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一。请回答:
(1)Q元素在周期表中的位置为________________。
(2)将这五种元素原子半径从大到小排列,排在第三的元素原子是______________(填元素符号)。
(3)元素的非金属性Z________Q(填“>”或“<”)。下列各项中,不能说明这一结论的事实有________(填序号)。
A.Q的氢化物的水溶液放置在空气中会变浑浊B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态 D.Z和Q在周期表中的位置
(4)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出阳离子B的立体构型为__________,离子中键角为_________;X与Q在一定条件下可以形成极不稳定的原子个数比为1:1的化合物,该化合物分子中既有极性键又有非极性键,写出该分子的结构式________________。
(5)M和N均为上述五种元素中的三种组成的化合物,且M和N都为强电解质,M和N在溶液反应既有沉淀出现又有气体产生,写出M和N反应的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c0(X)、c0(Y)、c0(Z)(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c0(X)、c0(Y)、c0(Z)(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A. c0(X)∶c0(Y)=3∶1
B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率不相等
D. c0(X)的取值范围为0 mol·L-1<c0(X)<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O![]() Cu2O+H2↑,装置如图,下列说法中正确的是
Cu2O+H2↑,装置如图,下列说法中正确的是
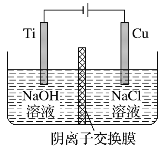
A. 电解时Cl-通过交换膜向Ti极移动
B. 阳极发生的反应为:2Cu -2e- +2OH- = Cu2O+H2O
C. 阴极OH-放电,有O2生成
D. Ti电极和Cu电极生成物物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。

请回答下列问题:
(1)Fe位于元素周期表中的位置是__________。
(2)写出流程中电解池里发生反应的离子方程式: __________。
(3)写出流程中“氯化”的化学方程式: __________。
(4)写出TiCl4完全水解生成TiO2·H2O的化学方程式: __________。
(5)高温炉中通入Ar的作用是___________。
(6)上述流程中可循环利用的物质有__________。
(7)下图为氯碱工业的装置示意图,使用______(填“阴”或“阳”)离子交换膜,目的除了降低分离氢氧化钠的成本外还可以________。
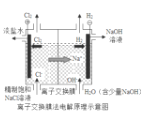
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com