
| A. | 加明矾使海水中的盐分沉淀而淡化 | |
| B. | 利用太阳能使海水蒸馏淡化 | |
| C. | 将海水缓慢凝固以获取淡化的饮用水 | |
| D. | 将海水通过离子交换树脂,以除去所含离子 |
分析 A.明矾水解生成胶体,不能与盐反应;
B.太阳能提供水蒸发需要的能量;
C.将海水缓慢凝固,使盐与水分离;
D.通过离子交换树脂,使某些离子选择性的通过.
解答 解:A.明矾水解生成胶体,不能与盐(氯化镁等)反应,则不能使海水中的盐分沉淀而淡化,故A错误;
B.太阳能提供水蒸发需要的能量,则利用太阳能使海水蒸馏淡化,故B正确;
C.将海水缓慢凝固,使盐与水分离,则可以获取淡化的饮用水,故C正确;
D.通过离子交换树脂,使某些离子选择性的通过,则可除去海水中所含离子,故D正确;
故选A.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、海水资源应用及混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 它们的原子半径、失电子能力随核电荷数的增加而增大 | |
| B. | 被其它卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大 | |
| C. | 它们的氢化物的稳定性随核电荷数的增加而增强 | |
| D. | 单质的颜色随核电荷数的增加而加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部可以 | B. | 仅②不可以 | C. | 仅②⑤不可以 | D. | ③④可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
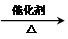
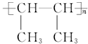 .
.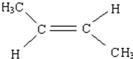 .
.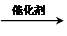 CH2=CH2+(CH3)2C=C(CH3)2.
CH2=CH2+(CH3)2C=C(CH3)2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将浓硝酸分别放在冷暗处和强光照射下,会发现强光照可以加快浓硝酸的分解 | |
| B. | 在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快 | |
| C. | 将相同大小、形状的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大 | |
| D. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,另一支试管不加;同时加热,产生氧气的快慢不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
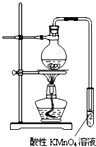 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.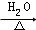 CH3CH2OH+NaBr.
CH3CH2OH+NaBr.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 序号 | 待除杂质(括号中为杂质) | 试剂 | 除杂方法 |
| A | 苯甲酸固体(NaCl固体) | 蒸馏水 | 重结晶 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 酒精(水) | 生石灰 | 蒸馏 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com