
【题目】人们发现氧化铁硫杆菌能促使黄铁矿(FeS2)氧化成硫酸铁和硫酸,氧化铁硫杆菌能把矿物中的硫或硫化物氧化成硫酸,而硫酸和硫酸铁能将某些矿石中的金属元素转化成金属硫酸盐,从而开辟了“细菌冶金”的先河。氧化铁硫杆菌的活动过程如图所示,其中a过程发生的反应为4FeS2+15O2+2H2O![]() 2Fe2(SO4)3+2H2SO4。则下列说法错误的是
2Fe2(SO4)3+2H2SO4。则下列说法错误的是

A.a过程中释放能量
B.细菌在反应a过程中起了催化剂的作用
C.b过程类似于植物的光合作用,细菌将能量储存在C6H12O6中
D.有些细菌可直接把含铅、汞等重金属的矿石溶解,得到重金属离子的溶液
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B 混合于 2L 的密闭容器中,发生下列反应:3A(g)+B(g) xC(g) +2D(g),经2min 后测得D 的浓度为 0.5mol·L-1,c(A)∶c(B)=3∶5,以 C 表示的平均速率 v(C)=0.25mol·L-1·min-1,下列说法正确的是( )
A.该反应方程式中,x=2B.2 min 时,A 的转化率为 50%
C.2 min 时,A 的物质的量为 0.75molD.反应速率 v(B)=0.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型药物H( )是一种可用于治疗肿瘤的药物,其合成路线如图所示:
)是一种可用于治疗肿瘤的药物,其合成路线如图所示:

已知:(1)E的分子式为C9H8O2,能使溴的四氯化碳溶液褪色
(2)![]() (R为烃基)
(R为烃基)
(3)![]()
请回答下列问题:
(1)A的结构简式为_____;D的官能团的名称为_____。
(2)①的反应类型是_____;④的反应条件是_____。
(3)写出B→C的化学方程式_____。
(4)写出F+G→H的化学方程式_____。
(5)E有多种同分异构体,同时满足下列条件的E的同分异构体有_____种。
ⅰ.能发生银镜反应 ⅱ.能发生水解反应 ⅲ.分子中含的环只有苯环
(6)参照H的上述合成路线,设计一条由乙醛和NH2CH(CH3)2为起始原料制备医药中间CH3CONHCH(CH3)2的合成路线_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓硫酸和乙醇制取乙烯时,常会看到烧瓶中液体变黑,制得的乙烯中混有CO2、SO2等杂质。某课外小组设计了如下装置,证明乙烯中混有CO2、SO2并验证乙烯的性质。
回答下列问题:
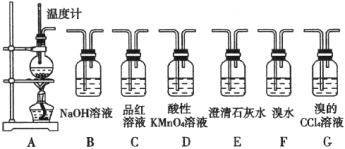
(1)装置A是乙烯的发生装置。图中一处明显的错误是__________,烧瓶中碎瓷片的作用是__________。
(2)若要检验A中所得气体含有SO2,可将混合合气体直接通入__________(填代号,下同)装置;若要检验,A中所得气体含有CH2=CH2,可将混合气体先通入B装置,然后通入__________装置。
(3)小明将从A出来的混合气体依次通过B、E、D、E,发现D前面的石灰水中无明显变化、D后面的石灰水变浑浊。请对出现该现象的原因进行合理猜想__________。
(4)写出实验室制取乙烯的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将有机物完全燃烧,生成CO2和H2O,将12 g该有机物完全燃烧产物通过浓硫酸,浓硫酸增重14.4 g,再通过碱石灰,又增重26.4 g。则该有机物的分子式为( )
A. C4H10 B. C2H6O
C. C3H8O D. C2H4O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景。PPG的一种合成路线如下:
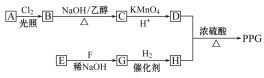
已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢
②化合物B为单氯代烃;化合物C的分子式为C5H8
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质
④R1CHO+R2CH2CHO![]()
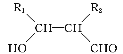
(1)根据信息①确定A的分子式为_____,结构简式为_________。
(2)G的化学名称是_____,所含官能团名称为________。
(3)G的同分异构体中,能与饱和NaHCO3溶液反应产生气体的有机物的结构简式为_______。
(4)化合物C的核磁共振氢谱中有____组峰。
(5)既能发生水解反应,又能发生银镜反应的G的同分异构体有_____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是元素周期表的一部分。
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
一 | A | |||||||
二 | D | J | L | |||||
三 | B | C | E | G |
根据以上元素在周期表中的位置,用元素符号或化学式填写空白。
(1)非金属性最强的元素是_____________;化学性质最不活泼的是__________;除L外,原子半价最大的是____________;A与D形成的10电子离子是_____________。/span>
(2)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、D、E四种元素的最高价氧化物对应水化物的化学式排列:___________。
(3)B元素与氧形成的既含有离子键,又含共价键的化合物的电子式为____________。
(4)B、C、G、J四种元素的简单离子的半径由大到小的顺序为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业常用燃料与水蒸气反应制备H2和CO,再用H2和CO合成甲醇。
(1)制取H2和CO通常采用:C(s)+H2O(g)CO(g)+H2(g)△H=+131.4kJmol-1,下列判断正确的是_______。
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g)C(s)+H2O(1)△H=﹣QkJmol-1,则Q<131.4
d.若C(s)+CO2(g)2CO(g)△H1;CO(g)+H2O(g)H2(g)+CO2(g)△H2则:△H1+△H2=+131.4kJmol-1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g)CO(g)+3H2(g)。已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如表:
不同时间各物质的物质的量/mol | ||||
0min | 2min | 4min | 6min | |
CH4 | 2.00 | 1.76 | 1.60 | n2 |
H2 | 0.00 | 0.72 | n1 | 1.20 |
根据表中数据计算:
①0min~2min 内H2的平均反应速率为_____________________。
②达平衡时,CH4的转化率为_____________;在上述平衡体系中再充入2.00mol甲烷1.00mol 水蒸气,达到新平衡时H2的体积分数与原平衡相比___________(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有__________(填字母)。
a.CO的含量保持不变 b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变 d.3υ正(CH4)=υ逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的。工作原理如图( c为隔膜,甲醇不能通过,其它离子和水可以自由通过):
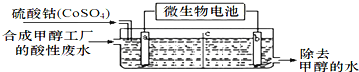
①a电极的名称为__________。
②写出除去甲醇的离子方程式______________________。
③微生物电池是绿色酸性料电池,写出该电池正极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸雨的主要成分是H2SO4,以下是形成途径之一:①NO2+SO2=NO+SO3,②2NO+O2=2NO2,③SO3+H2O=H2SO4,以下叙述错误的是
A. NO2由反应N2+2O2![]() 2NO2生成
2NO2生成
B. 总反应可表示为2SO2+O2+2H2O![]() 2H2SO4
2H2SO4
C. 还可能发生的反应有4NO2+O2+2H2O=4HNO3
D. 还可能发生的反应有4NO+3O2+2H2O=4HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com