
| A. | 由反应可确定:氧化性HClO3>HClO4 | |
| B. | 变蓝的淀粉碘化钾试纸褪色是因为可能发生了:4C12+I2+6H2O→12H++8Cl-+2IO3- | |
| C. | 若氯酸分解所得的混合气体的平均摩尔质量为47.6g/mol,则反应方程式可表示为:26HClO3→15O2↑+8C12↑+10HClO4+8H2O | |
| D. | 若化学计量数a=8,b=3,则该反应转移电子数为20e |
分析 A.根据氧化还原反应中氧化性:氧化剂>氧化产物分析;
B.试纸先变蓝后褪色,说明氯气可氧化碘单质;
C.根据混合气体的物质的量、质量,计算n(O2)、n(Cl2),确定b、c关系,再根据电子转移守恒、元素守恒配平方程式;
D.从化合价变化的角度计算转移的电子数.
解答 解:A.由题HClO3既是氧化剂又是还原剂,HClO4、O2是氧化产物、Cl2是还原产物,氧化剂的氧化性强于氧化产物,氧化性HClO3>HClO4,故A正确;
B.试纸先变蓝后褪色,说明氯气可氧化碘,反应的方程式为5Cl2+I2+6H2O═12H++10Cl-+2IO3-,故B错误;
C.n(Cl2)+n(O2)=1mol,n(Cl2)×71g/mol+n(O2)×32g/mol=47.6g,
解得n(Cl2)=0.4mol,n(O2)=0.6mol,故n(Cl2):n(O2)=2:3,与方程式中的计量数关系不同,故C错误;
D.若化学计量数a=8,b=3,由C分析可得化学反应方程式为8 HClO3=3O2↑+2 Cl2↑+4 HClO4+2H2O,电子转移数目为20e-,故D正确.
故选:BC.
点评 本题考查氧化还原反应反应的计算、配平、基本概念等,题目难度较大,D选项为易错点,涉及计算与配平,注意电子守恒的应用.


科目:高中化学 来源: 题型:选择题
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
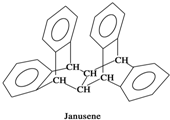 如图是一种形状酷似罗马两面神Janus的有机物结构简式,化学家建议将该分子叫做“Janusene”,下列说法正确的是( )
如图是一种形状酷似罗马两面神Janus的有机物结构简式,化学家建议将该分子叫做“Janusene”,下列说法正确的是( )| A. | Janusene的分子式为C30H20 | |
| B. | Janusene属于苯的同系物 | |
| C. | Janusene苯环上的一氯代物有8种 | |
| D. | Janusene既可发生氧化反应,又可发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 | B. | 7 | C. | 9 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液 | |
| B. | 过量的铁投入到一定量的稀硝酸中,充分反应后取上层清液于试管中,滴加KSCN溶液,溶液显红色 | |
| C. | 制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁 | |
| D. | 向CuSO4溶液中滴入过量NaOH溶液充分反应后,将混合液体倒入蒸发皿中加热煮沸一会,然后冷却、过滤,滤纸上的物质为“蓝色固体” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 萃取操作时,选择的萃取剂的密度必须比水大 | |
| D. | 分液操作时,上层液体从分液漏斗下口放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
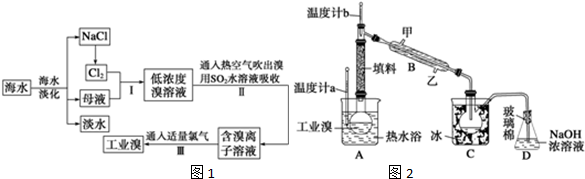
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com