
【题目】含钒石煤(含有铁、硅、铝、钙、镁等元素的氧化物)中的钒大部分是以V(Ⅲ)和V(Ⅳ)形式存在,由含钒石煤提钒的一种工艺流程如下所示:
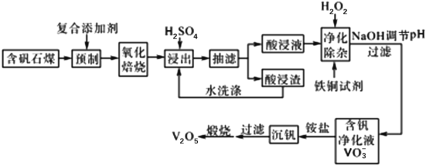
已知:铜铁试剂能与铜、铁、铝、钛等元素形成不溶于水的配合物。
回答下列问题:
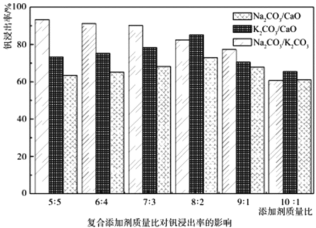
(1)含钒石煤预制时加入复合添加剂对钒浸出率的影响如图所示,其中最佳复合添加剂为______________。
(2)下图为“抽滤”实验原理装置图,“抽滤”时抽气泵的作用是______________;

(3)已知酸浸液中![]() 被
被![]() 氧化成
氧化成![]() ,其离子方程式为___________________。“净化除杂”时用铜铁试剂除去所含的
,其离子方程式为___________________。“净化除杂”时用铜铁试剂除去所含的![]() 、
、![]() 等杂质离子而不通过调节酸浸液pH的原因是_________________________________________________________。
等杂质离子而不通过调节酸浸液pH的原因是_________________________________________________________。
(4)“沉钒”的离子反应方程式为___________________。
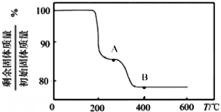
(5)“煅烧”纯净的沉钒产物过程中,固体残留率与温度变化如图所示。已知A点坐标为(260℃,85.47%),则A点对应物质的化学式为________________________,B点对应的物质为![]() ,则B点坐标为________________。
,则B点坐标为________________。
【答案】Na2CO3/K2CO3 抽走装置中的空气,形成负压,加快过滤速率 V2O24++H2O2=2VO2++2H+ 若调节酸浸液pH易生成Fe(OH)3、Al(OH)3胶体,胶体会吸附溶液中的钒酸根离子,造成钒损失 VO3-+NH4+=NH4VO3↓ HVO3 (400℃,77.78%)
【解析】
(1)读图找出最佳复合添加剂;
(2)从抽滤的原理来回答作用;
(3)结合氧化还原反应的规律写离子方程式,“净化除杂”时用铜铁试剂除去所含的Al3+、Fe3+等杂质离子而不通过调节酸浸液pH的原因,从两种方法的优劣比较来回答;
(4)读图找到产生沉淀的反应物,据此写“沉钒”的离子反应方程式;
(5)读图,结合质量守恒定律中元素质量守恒计算和化学反应规律回答。
(1)据图可知,在质量比相同的情况下,Na2CO3/K2CO3作复合添加剂时,钒浸出率最高,故最佳复合添加剂为Na2CO3/K2CO3;
(2)"抽滤"比过滤效果好速度快的原因是装置内外压强差大,故利用抽气泵抽走装置中的空气,使吸滤瓶中的压强降低,使过滤速度加快;
(3) V2O24+被H2O2氧化成VO2+,V2O24+作还原剂,V化合价升高,H2O2作氧化剂,O化合价降低,则离子方程式为:V2O24++H2O2=2VO2++2H+;
按信息,铜铁试剂能与铜、铁、铝、钛等元素形成不溶于水的配合物而除去,若调节酸浸液pH易生成Fe(OH)3、Al(OH)3胶体,胶体会吸附溶液中的钒酸根离子,造成钒损失;
答案为:若调节酸浸液pH易生成Fe(OH)3、Al(OH)3胶体,胶体会吸附溶液中的钒酸根离子,造成钒损失;
(4)据流程图知,“含钒净化液”中的VO3-与铵盐中NH4+结合生成NH4VO3沉淀,故“沉钒”的离子反应方程式为VO3-+NH4+=NH4VO3↓;
(5) 据图,260℃时NH4VO3分解生成HVO3和NH3,则剩余固体质量与初始固体质量的百分比为![]() ×100%≈85.47%,所以A点(260℃ )对应物质的化学式为HVO3;B点对应的物质为V2O5,根据质量变化特点,可以得出剩余固体质量与初始固体质量的百分比为
×100%≈85.47%,所以A点(260℃ )对应物质的化学式为HVO3;B点对应的物质为V2O5,根据质量变化特点,可以得出剩余固体质量与初始固体质量的百分比为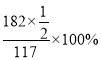 ≈77.78%,则B点坐标为(400℃,77.78%)。
≈77.78%,则B点坐标为(400℃,77.78%)。


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】已知:①标准状况下,1体积水中最多能溶解500体积的HCl;②饱和NaCl溶液的浓度约为5.00mol·L-1。
(1)在标准状况下,将448LHCl气体溶于1 L水中,所得溶液A的密度为1.20 g·cm-3,则溶液A中HCl的物质的量浓度为____。(本题计算结果均取三位有效数字)
(2)若使1L饱和氯化钠溶液中Cl-浓度与溶液A中的Cl-浓度相等,则在1LNaCl饱和溶液中还应溶解约___L标准状况下HCl气体(溶液体积变化忽略不计,不考虑氯化钠析出)。
(3)若将10.0mL溶液A稀释成500mL溶液B,则溶液B中HCl的物质的量浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的有( )
①氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂;
②测定新制氯水的pH时,先用玻璃棒蘸取液体滴在pH试纸上,再与标准比色卡对照
③用米汤直接检验食用盐中是否含有碘元素;
④pH在5.6~7.0之间的降水通常称为酸雨;
⑤加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO![]() 存在
存在
⑥SO2通入紫色石蕊试液,溶液先变红后褪色
⑦配制一定物质的量浓度的氢氧化钠溶液,用烧杯称量后加蒸馏水溶解,未冷却到室温便转移到容量瓶中,导致结果偏高
⑧分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤;
⑨蒸干AlCl3溶液可得纯净的无水氯化铝;
⑩2H2(g)+O2(g)=2H2O(g) △H1和2H2(g)+O2(g) =2H2O(l) △H2中的△H1>△H2。
A.5个B.6个C.7个D.8个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。

请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是________。
(2)反应①的化学方程式为_____________________________________
反应③的离子方程式为________________________
反应⑧的化学方程式为_____________________________________
(3)反应⑥过程中的现象是______________________________。
(4)1molI发生反应后生成的A高温下与足量的水蒸气反应,生成的气体换算成标准状况下占______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是

A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>:rZ>rW>rQ
C. 离子Y2-和Z 3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组研究金属钾的性质。他们首先通过分析钾与钠的原子结构示意图及查阅有关资料,知道钾与钠属于同一类物质,在性质上有许多相似之处。但在金属活动性顺序表中,钾排在钠的前面,钾在空气中燃烧的产物是超氧化钾(KO2)。
(1)预测钾的化学性质,完成下列反应的化学方程式:
①钾在氯气中燃烧____________________________;
②点燃钾剧烈燃烧_____________________________;
③将小块钾投入冷水中______________________________;
(2)推测钾在自然界中的存在方式是(填“游离态”或“化合态”)________。
(3)该小组研究钾的性质时用到的主要方法有____________________________________。
(4)他们研究金属钾性质的程序是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液,并用于烟气脱硫研究。
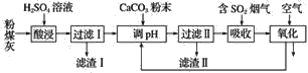
(1)酸浸时反应的化学方程式为_______________________________________________;滤渣Ⅰ的主要成分为________(填化学式)。
(2)滤渣Ⅱ的主要成分为________(填化学式);制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液的化学方程式为_________________________________________________________________。
(3)吸收烟气中SO2的化学方程式为Al2(SO4)3·Al2O3+3SO2=Al2(SO4)3·Al2(SO3)3。通入空气氧化,发生反应的化学方程式为_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有以下分子式的一溴代烷的所有同分异构体,水解后的产物,经催化氧化最多生成4种醛,则该一溴代烷的分子式可能是( )
A.C6H13BrB.C5H11BrC.C4H9BrD.C3H7Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com