
��NAΪ�����ӵ���������ֵ������˵����ȷ���ǣ��� ����
A��1mol?L -1��NaClO��Һ�к���ClO-����ĿΪNA
B�����³�ѹ�£���������ΪNA��NO2��CO2��������к��е���ԭ����Ϊ2NA
C����״���£�11.2 L CH3CH2OH �к��е���ԭ����ĿΪ3NA
D�������£�1L pH=13��Ba(OH)2��Һ�У�OH-������ĿΪ0.2NA
B
��������
���������A����Һ�����δ֪���������ӵ���Ŀ�����㣬����B������������NA������������ʵ�����1mol��NO2��CO2��������ƽ������ʽ�е�Oԭ�Ӹ�����2�����Ի�������к��е���ԭ����Ϊ2NA����ȷ��C����״���£��Ҵ�������̬������11.2L���Ҵ������ʵ�������0.5mol��������ԭ��������3NA������D�������£�pH=13��Ba(OH)2��Һ�У�OH-����Ũ��Ϊ0.1mol/L,����OH-������ĿΪ0.1NA������ѡB��
���㣺���鰢��٤������������Ӧ��


 ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д�
ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�Ͼ��и���9��ѧ����о���ѧ�Ծ��������棩 ���ͣ��ƶ���
��15�֣����������һ�����Ƹ�Ѫѹ��ҩ����м��壬����ͨ�����·����ϳɣ�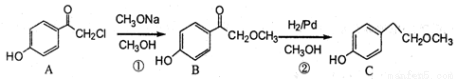
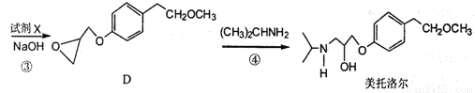
��ش��������⣺
��1����������еĺ���������Ϊ�ͣ������ƣ���
��2����Ӧ���м�����Լ�X�ķ���ʽΪC2H5OCl��X�Ľṹ��ʽΪ��
��3���������٢ڢ�������Ӧ�У�����ȡ����Ӧ���ǣ�����ţ���
��4��B��һ��ͬ���칹����������������
���ܷ���������Ӧ ������FeCl3��Һ������ɫ��Ӧ
��������4�ֲ�ͬ��ѧ�������⣬��1 mol������������Ʒ�Ӧ���� 1 mol H2��
д��һ�ָ�ͬ���칹��Ľṹ��ʽ����
��5����������֪ʶ�������Ŀ���������Ϣ��д����CH3OH��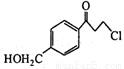 Ϊԭ���Ʊ�
Ϊԭ���Ʊ�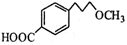 �ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£�
�ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£�
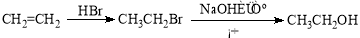
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫������ѧ����8�¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ������������۾���ȷ����
��� | ʵ����� | ʵ������ | ��������� |
A | ͭ��Ũ���ᷴӦ������������ʪ��KI-������ֽ���� | ��ֽ���� | NO2Ϊ�������� |
B | ��ij��Һ�м���ϡ�����ữ��BaCl2��Һ | �а�ɫ�������� | �ó���������BaSO4������Һ�п��ܺ���SO42�� |
C | ��ױ��е�������Ũ��ˮ�������� | ��Һ�ֲ㣬�ϲ�ʳȺ�ɫ���²㼸����ɫ | �ױ�����ˮ����ȡ����Ӧ��ʹ��ˮ��ɫ |
D | ��ϡAgNO3��Һ���ȼ������0.1mol/L NaCl��Һ,�ټ�������0.1mol/L NaI��Һ | �Ȳ�����ɫ����������ֻ�ɫ���� | ˵��Ksp(AgCl)��Ksp(AgI) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ�ع��и�����һ��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
NA��ʾ�����ӵ�������ֵ�������й�˵����ȷ����
A����״���£�22.4 LCH4��CH3CH2OH�Ļ��������������ΪNA
B�����³�ѹ�£�16 g14CH4����������ĿΪ8 NA
C��0.2 mol��Na2O2��ˮ��ȫ��Ӧת�Ƶĵ�����Ϊ0.2 NA
D��0.1 L 3 mol��L-1��NH4NO3��Һ�к��е�NH4+��ĿΪ0.3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡտ���и���8���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ��װ����;��ȷ����

A��װ��(��)����I2��NH4Cl�����ķ��롣
B��װ��(��)����ȥ��Fe(OH)3�����к��еĿ��������ʡ�
C��װ��(��)��Ƥ����ƽ����ѹ��ʹҺ��˳�����µ����á�
D��װ��(��)����HCl��NH3���գ��Է�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ�����и�����ѧ�ڵ�һ����У�������ۻ�ѧ�Ծ��������棩 ���ͣ������
��16�֣�������һ�ֳ��������ᡣ
��1������ij������Һ��c(CH3COOH)=0.10mol/L��c(H+)=1.3��10-3mol/L�����ʱc(CH3COO-)ԼΪ
mol/L�������ʱ����ĵ���ƽ�ⳣ����д��������̡�[ע: cƽ��(CH3COOH)��0.10mol/L��ˮ�ĵ���ɺ��Բ���]
��2��Ϊ��̽��þ�������ᡢ���ᷴӦʱ��Ũ�Ȼ��¶ȶԷ�Ӧ����(�۲�þ����ʧ��ʱ��)��Ӱ�죬�������»�ѧ��Ʒ��0.20 mol��L��1��0.40 mol��L��1��HCl��Һ��0.20 mol��L��1��0.40 mol��L��1��CH3COOH��Һ��4��þ��(��״����С��������ͬ)����֧�Թܺͽ�ͷ�ιܣ���Һ�¶ȿ���Ϊ298 K��308 K��
����Һ��ȡ��������ͬ�������������������ʵ����Ʊ���
ʵ�� ��� | �¶� (K) | ����Ũ�� (mol��L��1) | ����Ũ�� (mol��L��1) | ʵ��Ŀ�� |
a | 298 | 0.20 |
| I.ʵ��a��b��̽�� ��þ�����ᷴӦ���ʵ�Ӱ�죻 II��ʵ��a��c��̽�� ��þ�����ᷴӦ���ʵ�Ӱ�죻 III��ʵ��a��d��̽����ͬ�¶��£���ͬŨ�ȵ����ᡢ������þ��Ӧ���ʵ����� |
b | 308 | 0.20 |
| |
c | 298 | 0.40 |
| |
d |
|
|
|
��������ʵ��aþ����ʧ��ʱ����20 s����þ��ʣ��������ʱ���ϵͼ����ͼ�����裺�÷�Ӧ�¶�ÿ����10 �棬��Ӧ������ԭ����2�����¶���ͬʱ����������ͬŨ������ƽ���ٶȵ�1/2�����ڴ�ͼ�д��»�����ʵ��b������ʵ��d����þ��ʣ��������ʱ���ϵ���ߣ���ע���Ҫ�ı�ע��
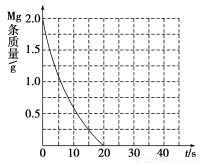
��3��þ���仯���������������������Ź㷺��Ӧ�ã�����þ�����ʡ���;�Ȼش��������⣺
��֪����Mg(s)��2H2O(g)===Mg(OH)2(s)��H2(g)����H1����441 kJ��mol��1��
��H2O(g)===H2(g)�� O2(g)����H2����242 kJ��mol��1��
O2(g)����H2����242 kJ��mol��1��
��Mg(s)�� O2(g)===MgO(s)����H3����602 kJ��mol��1��
O2(g)===MgO(s)����H3����602 kJ��mol��1��
��������þ�ֽ���Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ�����и�����ѧ�ڵ�һ����У�������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���������μ����ֽ��Ҳ���ϸ��ӡ�ijѧϰС����Mg(NO3)2Ϊ�о�������ͨ��ʵ��̽�����ȷֽ�IJ���������4�ֲ��룬���в���������
A��Mg(NO3)2��NO2��O2 B��MgO��NO2��O2
C��Mg3N2��O2 D��MgO��NO2��N2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ�����и�����ѧ�ڵ�һ��������⻯ѧ�Ծ��������棩 ���ͣ������
��16�֣�ˮú����CO ��H2������Ҫȼ�Ϻͻ���ԭ�ϣ�����ˮ����ͨ�����ȵ�̿���Ƶã�
C (s) + H2O(g)  CO (g) +H2 (g) ��H�� +131.3 kJ?mol��1
CO (g) +H2 (g) ��H�� +131.3 kJ?mol��1
��1���÷�Ӧ��ƽ�ⳣ��K���¶ȵ����߶�___________������ / ��С / ���䣩��
��2��������Ӧ�ﵽƽ�����ϵ�е�C (s)ȫ�����ߣ�ƽ��_______________�������� / ������ / ���ƶ�����
��3��������ʵ��˵���÷�Ӧ��һ���������Ѵﵽƽ��״̬����_______������ţ���
A����λ�����ÿ����1 mol CO��ͬʱ����1molH2
B��������������ʵ������ֲ���
C������H2O(g)������������CO���������
D��H2O(g)��CO��H2��Ũ�����
��4��������Ӧ��t0ʱ�̴ﵽƽ�⣨����ͼ��������t1ʱ�̸ı�ijһ������������ͼ�м�������t1ʱ��֮��c(CO)��ʱ��ı仯��

�� ��С�����������ʵ�߱�ʾ����
�� �����¶ȣ������߱�ʾ����
��5��ij�¶��£���6.0 mol H2O(g)��������̿����2 L���ܱ������У��������·�Ӧ��
C (s) + H2O(g)  CO (g) +H2 (g)���ﵽƽ��ʱ���lgK= -1.0������¶���H2O(g)��
CO (g) +H2 (g)���ﵽƽ��ʱ���lgK= -1.0������¶���H2O(g)��
ת���ʣ�����������3λ��Ч���֣�Ҫ��д��������̣���
��6����֪���� C (s) + H2O(l)  CO (g) +H2 (g) ��H1
CO (g) +H2 (g) ��H1
�� 2CO(g) + O2(g) �� 2CO2 (g) ��H 2
�� H2O (l)�� H2 (g) +1/2 O2 (g) ��H 3
��2C (s) + O2 (g) �� 2CO2 (g)�ġ�H �� _________ ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�찲��ʡ�������·ݻ�ѧ�¿��Ծ��������棩 ���ͣ�ѡ����
���з���������ԭ�Ӷ����������8���ӽṹ����
A���������� B��������COCl2�� C��������� D����������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com