
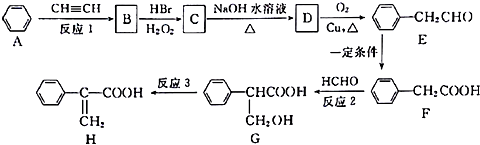
 .
. +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaBr.
+NaBr. .
. 分析 根据题中各物质转化关系,对比A、E的结构可知,苯与乙炔发生加成反应生成B为 ,由E的结构可反推得D为
,由E的结构可反推得D为 ,B在双氧水的条件下与溴化氢发生加成反应得C,C在碱性条件下水解得D,所以C为
,B在双氧水的条件下与溴化氢发生加成反应得C,C在碱性条件下水解得D,所以C为 ,E发生氧化反应得F,F与甲醛发生加成反应得G,G发生消去反应得H,据此答题.
,E发生氧化反应得F,F与甲醛发生加成反应得G,G发生消去反应得H,据此答题.
解答 解:根据题中各物质转化关系,对比A、E的结构可知,苯与乙炔发生加成反应生成B为 ,由E的结构可反推得D为
,由E的结构可反推得D为 ,B在双氧水的条件下与溴化氢发生加成反应得C,C在碱性条件下水解得D,所以C为
,B在双氧水的条件下与溴化氢发生加成反应得C,C在碱性条件下水解得D,所以C为 ,E发生氧化反应得F,F与甲醛发生加成反应得G,G发生消去反应得H.
,E发生氧化反应得F,F与甲醛发生加成反应得G,G发生消去反应得H.
(1)根据G的结构简式可知,G中含氧官能团的名称是羟基和羧基,由上述分析可知,B的结构简式为: ,
,
故答案为:羟基、羧基; ;
;
(2)C→D的化学方程式是: +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaBr,
+NaBr,
故答案为: +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaBr;
+NaBr;
(3)对比物质的结构可知,反应2的反应类型为加成反应,反应3是醇的消去反应,所以反应条件为:浓硫酸、加热,
故答案为:加成反应;浓硫酸、加热;
(4)a.B为 ,B中有苯环结构和碳碳双键结构,选择碳碳单键,两个平面可以重合,所以B中所有原子可能在同一平面上,故a正确;
,B中有苯环结构和碳碳双键结构,选择碳碳单键,两个平面可以重合,所以B中所有原子可能在同一平面上,故a正确;
b.合成路线中所涉及的有机物中乙炔不含苯环,不是芳香族化合物,故b错误;
c.H中苯环与碳碳双键能与氢气发生加成反应,一定条件下1mol有机物H最多能与4mol He发生反应,故c错误;
d.G中含有羟基和羧基以及苯环,所以G能发生取代、加成、消去、氧化、缩聚等反应,故d正确,
故选:ad;
(5)化合物G的同分异构体,满足下列条件:①能发生水解反应和银镜反应,说明有甲酸酯,②能与FeCl3,发生显色反应,说明有酚羟基,③核磁共振氢谱只有4个吸收峰的同分异构体的结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成、官能团结构与性质、有机反应类型、化学方程式书写、限制同分异构体的书写等,是对学生综合能力的考查,注意利用有机物的结构及反应条件进行分析解答,需要学生熟练掌握官能团的性质与转化,难度中等.


科目:高中化学 来源: 题型:选择题
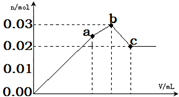 向100mL 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.下列说法不正确的( )
向100mL 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.下列说法不正确的( )| A. | a点的溶液呈酸性的原因为:NH4++H2O?NH3•H2O+H+ | |
| B. | c点沉淀的质量比a点沉淀的质量大 | |
| C. | b点加入Ba(OH)2溶液的体积为150mL | |
| D. | 至c点完成反应,反应的离子方程式可表示为:Al3++2SO42-+NH4++2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 编 号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100mL | 200mL | 300mL | 400mL |
| 剩余金属/g | 18.0g | 9.6g | 0 | 0 |
| NO体积/L(标准状况下) | 2.24L | 4.48L | 6.72L | V |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂水解可得到氨基酸和甘油 | |
| B. | 防腐剂都有一定的毒性,所以不能吃含防腐剂的食品 | |
| C. | 蛋白质溶液、淀粉溶液都属胶体 | |
| D. | 玻璃钢是新型的无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
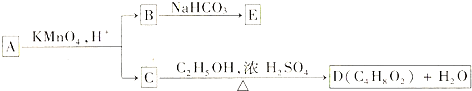
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
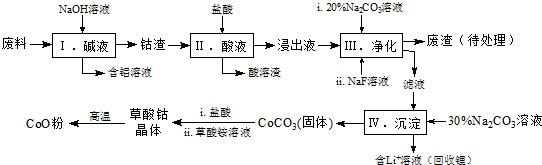
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
 Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol].
Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol].查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向盛有少量Mg(OH)2沉淀的试管中滴加适量NH4Cl溶液,沉淀溶解:Mg(OH)2+2NH4+═2NH3•H2O+Mg2+ | |
| B. | SO2通入澄清石灰水中,产生白色沉淀:SO2+Ca2++2OH-═CaSO4↓+H2O | |
| C. | 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++2 HCO3-+2 OH-═CaCO3↓+CO32-+2H2O | |
| D. | 长期过量服用阿司匹林出现水杨酸(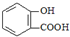 )反应,可静脉注滴NaHCO3溶液: )反应,可静脉注滴NaHCO3溶液: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com