

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| +CO | 2 3 |
| +SO | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:安徽省合肥市2010年高三第一次教学质量检测 题型:填空题
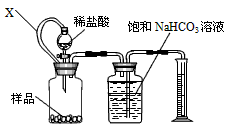
工业上用重晶石(BaSO4)制备BaCO3的常用方法主要有高温煅烧还原法、沉淀转化法等。高温煅烧还原法的工艺流程可简单的表示如下:
已知:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H="+571.2" kJ?mol-1
Ba(s)+S(s)+2O2(g):BaSO4(s)△H=—1473.2 kJ?mol-1
Ba(s)+S(s)=BaS(g)△H=—460 kJ?mol-1
请回答:
(1)工业上煅烧重晶石矿粉时,为使BaSO4得到充分还原和维持反应所需的高温,应采取的措施是 。
(2)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4(s)+CO2-3(aq)=BaCO3(s)+SO2-4(aq)
则:在实验室中将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为
(3)与高温煅烧还原法相比,用饱和Na2CO3溶液沉淀转化法的优点主要有
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省梅州市高三总复习质检试卷理综化学试卷(解析版) 题型:计算题
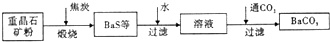
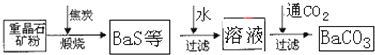
工业上用重晶石(BaSO4)制备BaCO3的常用方法主要有高温锻烧还原法、沉淀转化法等。高温煅烧还原法的工艺流程可简单的表示如下:

(1)若“煅烧”时产生一种有毒的还原性气体,则反应的化学方程式为______。
(2)工业上煅烧重晶石矿粉时,为使BaSO4得到充分的还原和维持及应所需的高温,应采取的措施是______。
a.加人过量的炭,同时通入空气 b.设法将生成的BaS及时移出
(3)在第一次过滤后洗涤,检验是否洗涤干净的试剂最好是______。
(4)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4 (s)+CO32-(aq)  BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)
则:①在实验室将少量BaSO4固体全部转化为BaCO3的实验操作方法与步骤为______。
②与高温煅烧还原法相比,沉淀转化法的优点主要有______。
③已知:Ksp(BaCO3)=2.40×10-9,Ksp(BaSO4)=1.20×10-10。现欲用沉淀转化法将BaSO4转化为BaCO3,该反应的平衡常数为______。如用1.00 L 0. 210 mol • L-1 Na2CO3溶液处理,试计算BaSO4被转化的质量______(要有计算过程,结果保留3位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com