
【题目】中国古代四大发明之一的黑火药,它的爆炸反应为:
2KNO3+3C+S![]() A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①除S外,上列元素的电负性从大到小依次为 。
②在生成物中,A的晶体类型为 ;含极性共价键的分子的中心原子轨道杂化类型为___________________。
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为_______ 。
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】钢铁等铁制品是应用最广泛的金属材料,铁元素的单质及其化合物在元素化合物世界始终扮演着重要角色。
I、打磨过的细铁丝可在纯氧中剧烈燃烧,最终生成黑色固体;铁粉与水蒸气在高温下也可生成该黑色固体,
(1)反应的化学方程式为 。
(2)将该黑色固体溶于盐酸中,反应的离子反应方程式 。
II、某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:

请回答下列问题:
(1)步骤②中,除发生反应Fe +2HCl=FeCl 2 +H 2 ↑外,其他可能反应的离子方程式为 。
(2)若将③该加H2O2 书写离子反应方程式 。
(3)若溶液B中只含有Fe 2+ 而不含Fe 3+ ,可证明该事实的实验方法是( )
①先加氯水,后加KSCN溶液后显红色;
②先加KSCN溶液,不显红色,再加氯水后显红色;
③滴加NaOH溶液,只产生白色沉淀,迅速变为灰绿色,最后呈红褐色;
④只滴加KSCN溶液不显红色。
A.①② B、②③ C、③④ D、①④
(4)步骤④化学方程式为 。
(5)若除去氯化铜中氯化铁可以加入剂 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对事实的解释不正确的是
选项 | 事实 | 解释 |
A | 用铝罐槽车储运浓硫酸 | 常温下,铝与浓硫酸不反应 |
B | 在蔗糖中加入浓硫酸后出现发黑 | 浓硫酸具有脱水性 |
C | 浓硝酸在光照下颜色变黄 | 浓HNO3不稳定,生成的有色产物NO2能溶于浓硝酸 |
D | SO2能使溴水褪色 | SO2具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列说法的判断正确的是
A. 漂白粉在空气中不稳定,可用于漂白纸张
B. 漂白粉中的CaCl2与空气中的CO2反应可生成CaCO3,漂白粉在空气中久置变质
C.NH3能使酚酞溶液变红,因而NH3可用于设计喷泉实验
D. 打磨磁石制指南针不涉及化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiCIO4。溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。

回答下列问题:
(1)外电路的电流方向是由____极流向____极。(填字母)
(2)电池正极反应式为__ __。
(3)是否可用水代替电池中的混合有机溶剂?____(填“是”或“否”),原因是_________ ___。
(4)MnO2可与KOH和KClO3,在高温下反应,生成K2MnO4,反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝镁合金已成为飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.
【方案一】
【实验方案】将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是______.
【实验步骤】
(1)称取10.8g铝镁合金粉末样品,溶于V 、物质的量浓度为4.0mol/L NaOH溶液中,充分反应。则NaOH溶液的体积V≥______mL。
(2)过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得镁的质量分数将______(填“偏高”、“偏低”或“无影响”).
【方案二】
【实验方案】将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积.
【实验步骤】
(1)同学们拟选用下列实验装置完成实验:
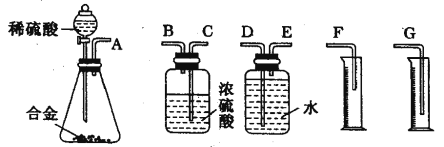
你认为最简易的装置其连接顺序是:A→( )→( )→( )→( )→( )(填接口字母,可不填满)。
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸 滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置.
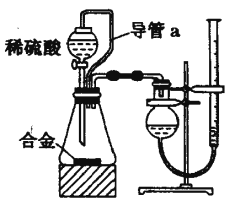
①装置中导管a的作用是______.
②实验中将碱式滴定管改装成量气管,且实验前后量气管中液面读数分别为V1 mL、V2 mL.则产生氢气的体积为______mL。
③若需确定产生氢气的物质的量,还需测定的数据是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为苯和溴的取代反应的实验装置图,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉。
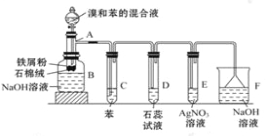
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒内就发生反应。写出A中所发生反应的化学方程式: _________________ _____。
(2)试管C中苯的作用是_________。反应开始后,观察D和E两试管,看到的现象为_________。
(3)反应2 min~3 min后,在B中的NaOH溶液里可观察到的现象是_______________。
(4)在上述整套装置中,具有防倒吸作用的仪器有_____ ___(填字母)。
(5)该实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这三个优点外,还有一个优点是_____ _ _ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SnSO4是一种重要的硫酸盐,在工业生产中有着广泛的应用。其制备路线如下:
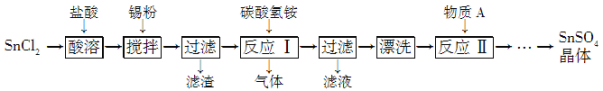
已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+; SnCl2能水解生成碱式氯化亚锡 Sn(OH)Cl]。
(1) 写出物质A的名称:___ _____。
(2) SnCl2用盐酸而不用水溶解的原因是__________ __________(用化学方程式表示)。
(3) 锡粉的作用是除去酸溶时产生的少量Sn4+,请写出产生Sn4+的离子方程式:
_______________ _______________。
(4) 反应Ⅰ生成的沉淀为SnO,写出该反应的化学方程式:_ _ __。该反应的温度需要控制在75 ℃左右的原因是_ _ _ _。
(5) 实验室中“漂洗”沉淀的实验操作方法是_ _ __。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质能真实表示物质分子组成的是( )
A.NO、C2H5OH、HNO3、I2
B.CaO、N2、HCl、H2O
C.NH3、H2S、Fe、CO
D.CO2、SiO2、CH3COOH、H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com