
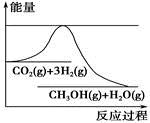
为了变废为宝,控制温室效应,工业上可用CO2来生产甲醇。一定条件下发生如下反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是
CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是
A.降低温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来
D.再充入1 mol CO2和3 mol H2
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)1.1中和反应反应热的测定(解析版) 题型:实验题
利用如图所示装置测定中和热的实验步骤如下:
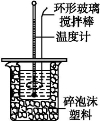
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量? 。
(2)倒入NaOH溶液的正确操作是 (填序号)。
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是 (填序号)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为 。
(5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1· ℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH= (结果保留一位小数)。
(6) (填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学铁及其化合物主要性质(解析版) 题型:实验题
某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。
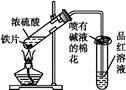
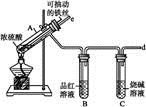
图1 图2
(1)比较两实验装置,图2装置的优点是:
①能更好地吸收有毒气体SO2,防止其污染环境;
② 。(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而污染环境;二是 。(3)能说明有SO2气体产生的实验现象是 。(4)反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
A.稀HCl溶液 B.稀H2SO4溶液
C.KSCN溶液 D.KMnO4溶液
E.NaOH溶液 F.淀粉KI溶液
G.H2O2溶液
验证Ⅱ:取试样,先滴加少量的 (填试剂序号,下同),振荡,再滴加少量的 ,根据溶液颜色的变化可确定假设Ⅱ是否正确。反应的离子方程式是 ,Fe3++3SCN- Fe(SCN)3。验证III:步骤1.取试样,滴加少量的 (填试剂序号),溶液的颜色变 色,则试样中含有Fe3+。步骤2.再取适量的试样滴加到少量的 (填试剂序号),观察到的现象为 ,则试样中含有Fe2+。
Fe(SCN)3。验证III:步骤1.取试样,滴加少量的 (填试剂序号),溶液的颜色变 色,则试样中含有Fe3+。步骤2.再取适量的试样滴加到少量的 (填试剂序号),观察到的现象为 ,则试样中含有Fe2+。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学钠及其化合物主要性质(解析版) 题型:选择题
已知X、Y、Z、W均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物已略)。下列说法不正确的是
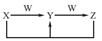
A.X、Y、Z中至少有一种相同的元素,该元素可以是金属元素也可以是非金属元素
B.物质W可能是化合物,也可能是单质
C.上述转化关系中不可能出现置换反应
D.若X、Y、Z中均含有一种常见金属元素,则W可能是强酸也可能是强碱
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学速率表示与平衡移动(解析版) 题型:实验题
某化学小组设计如图实验装置
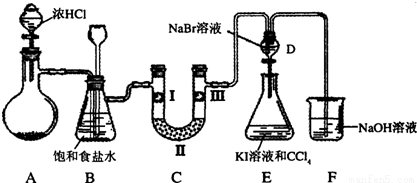
(1)若装置A中的固体药品为KClO3,则写出离子方程式 。
(2)装置B既能除去氯气中的氯化氢,还能检测实验过程中装置C是否发生堵塞。若C中发生堵塞,B中将观察到的现象是 。
(3)装置C的作用是验证氯气是否具有漂白性,l处是湿润的有色布条,则Ⅱ、Ⅲ处应加入的物质分别是 , 。
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。请简述能说明氯、溴、碘非金属性强弱的实验操作及现象 。(夹持装置略去)制备Cl2并探究氯气的相关性质:
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学速率表示与平衡移动(解析版) 题型:选择题
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如下图所示。下列判断正确的是
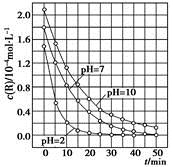
A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等
B.溶液酸性越强,R的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习5(解析版) 题型:填空题
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):

填写下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸气在t ℃,p k Pa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量,该反应的热化学方程式是 。
(2)上述流程中,工业上分离H2 、CO2合理的方法是 。
A混合气先通入氢氧化钠溶液,再在溶液中加盐酸
B混合气加压冷却,使CO2液化
C混合气用氨水洗涤
D混合气先通入到石灰浆,然后高温煅烧固体,
(3)为了保证氨气顺利合成,在空气进入合成塔之前必须对空气进行 ,目的是____________________;在合成氨的实际生产过程中,常采取将生成的氨从混合气体中分离出来,分离出氨的方法 。
(4)合理地利用资源不仅可以提高经济效益,而且也是对社会、对全人类负责的表现,阐述图中的两处可以合理利用资源情况 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子的性质及检验(解析版) 题型:选择题
一包白色粉末,由几种常见的盐混合组成,其中只可能含有Na+、K+、Al3+、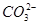 、
、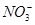 、
、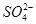 、
、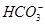 、
、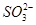 中的若干种离子。某同学对该溶液进行如下实验:
中的若干种离子。某同学对该溶液进行如下实验:
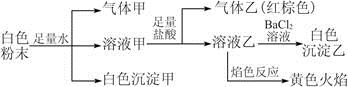
以下说法正确的是
A.白色沉淀甲是Al(OH)3,气体甲是CO2,所以混合物一定含Al3+和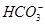
B.气体乙一定是NO和NO2的混合气体
C.白色沉淀乙是BaSO4,所以原混合物一定含有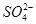
D.焰色反应为黄色火焰,不能确定原混合物中不含K+
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习3(解析版) 题型:填空题
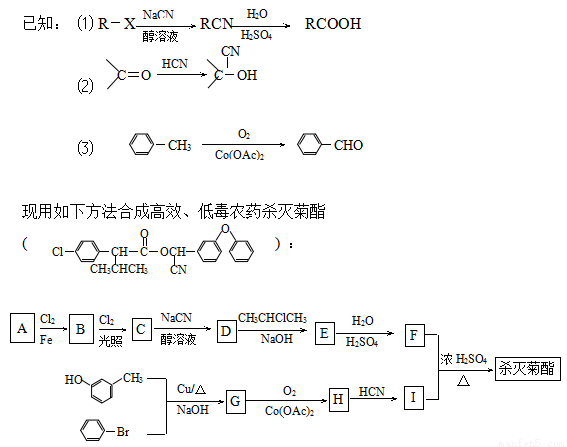
(1)原料A是苯的最简单的同系物,其名称是 ;合成G的反应类型是 。
(2)写出B的结构简式 。
(3)写出反应D→E的化学方程式: 。
(4)杀灭菊酯的核磁共振氢谱共有 种峰。
(5)氨基酸X与I互为同分异构体,且X是萘(  )的一取代物,含有碳碳叁键,X所有可能的结构共有 种。高聚物Y是由X通过肽键连接而成,Y的结构简式是 (只要求写一种)。
)的一取代物,含有碳碳叁键,X所有可能的结构共有 种。高聚物Y是由X通过肽键连接而成,Y的结构简式是 (只要求写一种)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com