
| A、常温常压下,32g O2和O3的混合气体中含有的原子数为2NA |
| B、标准状况下,33.6L的1H2和3H2均含有3NA个氢原子 |
| C、1mol 131I原子和1mol 123I原子相差4NA个质子 |
D、核外电子分布为 的原子与核外电子排布为 的原子与核外电子排布为 的原子形成1mol化合物时,转移的电子数是NA 的原子形成1mol化合物时,转移的电子数是NA |
| V |
| Vm |
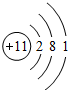 为Na原子,
为Na原子,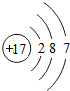 为Cl原子,二者结合生成NaCl.
为Cl原子,二者结合生成NaCl.| 32g |
| 16g/mol |
| 3.36L |
| 22.4L/mol |
 表示Na原子,
表示Na原子, 为Cl原子,二者结合生成1mol氯化钠时转移了1mol电子,转移的电子数是NA,故D正确;
为Cl原子,二者结合生成1mol氯化钠时转移了1mol电子,转移的电子数是NA,故D正确;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| X | Y |
| Z | W |
| A、若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n为正整数) |
| B、若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱 |
| C、若四种元素均为非金属,则W的最高价氧化物对应的水化物一定是强酸 |
| D、若四种元素只有一种为金厲,则Z、Y 二者的最高价氧化物对应的水化物一定能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:


| KMnO4/H+ |
 (-R1、-R2-表示氢原子或烃基)
(-R1、-R2-表示氢原子或烃基)| 稀NaOH |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
 已知水在25℃和95℃时,其电离平衡曲线如图所示.
已知水在25℃和95℃时,其电离平衡曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾可用于水的消毒,杀菌 |
| B、生石灰、铁粉,硅胶是食品包装中常用的干燥剂 |
| C、福尔马林可作食品的保鲜剂 |
| D、二氧化硅可用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
| B、“地沟油”经过加工处理后,可以用来制肥皂和生物柴油 |
| C、食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质 |
| D、二氧化硫的大量排放是造成光化学烟雾的主要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:
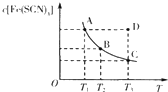 已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )
已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )| A、A点与B点相比,A点的c( Fe3+)大 |
| B、加入KCl固体可以使溶液由D点变到C点 |
| C、反应处于D点时,一定有υ(正)<υ(逆) |
| D、若T1、T2温度下的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有W、A、B、C、D、E、F七种前四周期元素,原子序数依次增大.目前公认W、A都各自形成的化合物种类最多.A、B、C位于同周期且第一电离能按A、C、B的顺序依次增大.D、E位于同主族,且D的原子序数为12.F的单质为紫红色常见金属.请回答下列问题:
现有W、A、B、C、D、E、F七种前四周期元素,原子序数依次增大.目前公认W、A都各自形成的化合物种类最多.A、B、C位于同周期且第一电离能按A、C、B的顺序依次增大.D、E位于同主族,且D的原子序数为12.F的单质为紫红色常见金属.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、途径②增大02浓度可提高SO2转化率 |
| B、含l mol H2S04的浓溶液与足量NaOH反应,放出的热量即为中和热 |
| C、途径②中S02和S03均属于酸性氧化物 |
| D、若△Hl<△H2+△H3,则2H202(aq)=2H20(1)+02 (g)为放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com