
| A.相同条件下,产生气体的体积相等 |
| B.生成的铝的化合物的物质的量相等 |
| C.消耗酸和碱的物质的量相等 |
| D.相同条件下,转移的电子数相等 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.0.56L | B.0.70 L | C.0.72L | D.0.84 L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1组 | B.2组 | C.3组 | D.4组 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.005 mol |
| B.0.010 mol |
| C.0.020 mol |
| D.0.030 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
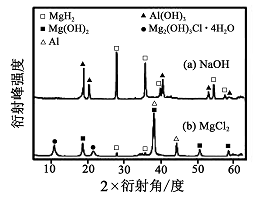
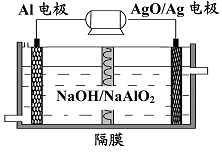
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.利用铝与氧化铁发生的铝热反应来焊接钢轨 |
| B.向某种消毒液( NaC1O)中滴加醋酸,能抑制NaC1O水解,降低漂白效果 |
| C.医用双氧水涂抹伤口时,有气泡产生,这是由溶解在血液中的O2、CO2逸出形成的 |
| D.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

| 较大量存在的含金属元素的离子 | 检验方法 |
| | |
| | |
| | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题




| | Fe2+ | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com