
【题目】LiBH4为近年来储氢材料领域的研究热点。
(1)反应2LiBH4=2LiH+2B+3H2↑,生成22.4 L H2(标准状况)时,转移电子的物质的量为____mol。
(2)下图是2LiBH4/MgH2体系放氢焓变示意图,则:
Mg(s)+2B(s)=MgB2(s) △H=________。

(3)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①如图为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图。由图可知,下列说法正确的是____(填字母)。

a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②如图为25℃和75℃时,Al-LiBH4复合材料[ω(LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。

从图中分析,25℃时Al-LiBH4复合材料中与水完全反应的物质是___________(填化学式),产生Al(OH)3的化学方程式为_________________。
(4)如图是直接硼氢化钠-过氧化氢燃料电池示意图。该电池工作时,正极附近溶液的pH________(填“增大”、“减小”或“不变”),负极的电极反应式为________________________。
【答案】2 -93 kJ·mol-1 ab LiBH4 2Al+6H2O=2Al(OH)3+3H2↑ 增大 BH4--8e-+8OH-=BO2-+6H2O
【解析】
(1)LiBH4中氢元素化合价为-1价,生成1mol氢气转移电子2mol;
(2)能量由上到下分别为1、2、3、4,则该反应的焓变为-(1+3-2-4)= -93 kJ·mol-1;
(3)①a、图中当全为铝时气体为0,故纯铝与水不反应,故正确;
b、f线代表纯LiBH4与水反应产生氢气,故正确;
c、当材料含LiBH4为25%时(d线),产生氢气的量最多,故错误;
答案选ab;
②由图得出反应后已没有LiBH4,但存在大量铝,故其完全反应,与水完全反应的物质是LiBH4;铝部分反应(有氢氧化铝等铝的产物),反应化学方程式为2Al+6H2O=2Al(OH)3+3H2↑;
(4)右室双氧水得到电子为正极,电极反应式为H2O2+2e-=2OH-,故该极碱性增强,负极为BH4--8e-+8OH-=BO2-+6H2O。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,不正确的是
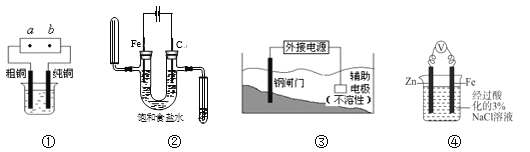
A. 用装置①精炼铜,则a极为电源正极,电解质溶液可为CuSO4溶液
B. 用湿润的淀粉-KI试纸检验装置②中阳极气体产物时,试纸变为蓝色
C. 装置③中钢闸门应与外接电源的负极相连,该保护法称为“牺牲阳极的阴极保护法”
D. 装置④中反应一段时间后,取Fe电极附近溶液滴加铁氰化钾溶液,不会产生蓝色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质

(1)Ti是一种活泼金属,原子核内有22个质子,它在周期表中的位置是____________。
(2)根据上表信息推测TiCl4中含有的化学键类型是_______________。
(3)MgCl2的电子式为____________。
(4)氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_________________。
(5)精制过程:粗TiCl4经两步蒸馏得纯TiCl4如图。

①物质a是__________________(填化学式)。
②T1应控制在______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃,它们分子里的碳原子数相等.将1.0体积这种混合气体在氧气中完全燃烧,生成2.0体积的CO2和2.4体积的水蒸气(气体体积均在相同状况下测定),则混合气体中烷烃和烯烃的体积比为( )
A.3:1 B.1:3 C.2:3 D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置正确且能达到对应实验目的的是
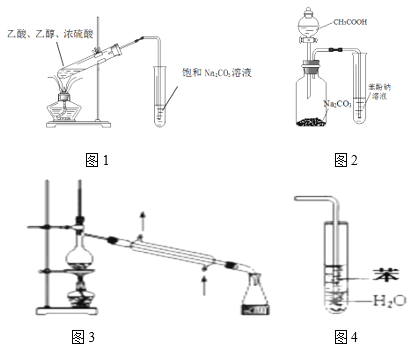
A. 用图1装置制备乙酸乙酯
B. 用图2装置比较乙酸、碳酸、苯酚的酸性强弱
C. 图3常用于分离熔沸点不同的液体混合物
D. 图4可用于吸收HCl气体,并防止倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把含(NH4)2SO4和NH4NO3的混合液aL分成两等份。一份加入bmolNaOH并加热,恰好把NH3全部赶出;另一份需消耗cmolBaCl2沉淀反应恰好完全,则原溶液中NO3-的浓度为()
A.![]() mol/LB.
mol/LB.![]() mol/LC.
mol/LC.![]() mol/LD.
mol/LD.![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离NaCl和BaCl2两种固体混合物,回答下列问题:

供选试剂:Na2CO3溶液、Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作②的名称是___________。
(2)试剂a是___________(填化学式,下同),试剂b是___________,固体B是___________。
(3)加入试剂a所发生的化学反应方程式为________________________。
(4)该方案能否达到实验目的?___________(填“能”或“不能”)。若不能,应如何改进(若能,此问不用回答)________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C—C可以绕键轴旋转,对于结构简式如图所示的烃,下列说法正确的是
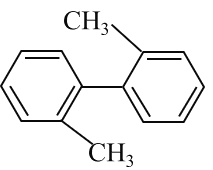
A.该物质不能发生加成反应
B.分子中至少有9个碳原子处于同一平面上
C.该烃的一氯取代物最多有5种
D.该烃是苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是核电荷数依次增大的六种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置_________
(2)F元素的最高价氧化物对应的水化物的化学式为________。
(3)元素C、D、E形成的简单离子半径由小到大的顺序________(用离子符号表示)。
(4)写出化合物D2C2的电子式:________。
(5)E、F的简单离子的还原性大小顺序为:_________。
(6)已知E单质和F单质的水溶液反应会生成两种强酸,其离子方程式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com