
【题目】I.在298K、100 kPa时,已知:①2H2O(g)![]() O2(g)+2H2(g) △H1 K1
O2(g)+2H2(g) △H1 K1
②Cl2(g)+H2(g) ![]() 2HCl(g) △H2 K2
2HCl(g) △H2 K2
③2Cl2(g)+2H2O(g![]() 4HCl(g)+O2(g) △H3 K3
4HCl(g)+O2(g) △H3 K3
则△H1、△H2、△H3间的关系是_________,K1、K2、K3间的关系是___________。
II.高温下,炼铁高炉中存在下列平衡:FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H>0。试回答下列问题:
Fe(s)+CO2(g) △H>0。试回答下列问题:
(1)写出该反应的平衡常数表达式________。
(2)升高温度,该反应的平衡常数K值将________(填“增大”、“减小”、“不变”),平衡体系中固体的质量将________填“增大”、“减小”、“不变”)。
(3)已知1100℃时该反应的平衡常数K=0.263。在该温度测得高炉中c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,此时该化学反应的速度是v(正)______ v(逆)(填”>”、“<”、“=”),原因是________。
(4)保持高炉温度为1100 ℃,向高炉中补充大量的空气,重新达到平衡后,该反应的平衡常数K值________0.263(填”>”、“<”、“=”)。
【答案】△H1=△H3-2△H2 K1=![]()
![]() 增大 减小 > 该条件下气体的浓度商小于该温度下的化学平衡常数,说明反应正向进行 =
增大 减小 > 该条件下气体的浓度商小于该温度下的化学平衡常数,说明反应正向进行 =
【解析】
I.根据盖斯定律,将已知热化学方程式叠加,可得三者关系;利用化学平衡常数的含义,判断三个反应的平衡常数的关系;
II.(1)根据化学平衡概念为生成物浓度幂之积与反应物浓度幂之积之比书写,注意固体不写入表达式;
(2)利用该反应为吸热反应,根据平衡移动原理分析温度对平衡的影响,判断平衡常数、固体质量变化情况;
(3)根据浓度计算浓度商,结合平衡常数进行比较判断反应进行的方向;
(4)平衡常数只受温度影响,温度不变,平衡常数不变。
I.①2H2O(g)![]() O2(g)+2H2(g) △H1 K1
O2(g)+2H2(g) △H1 K1
②Cl2(g)+H2(g)![]() 2HCl(g) △H2 K2
2HCl(g) △H2 K2
③2Cl2(g)+2H2O(g![]() 4HCl(g)+O2(g) △H3 K3
4HCl(g)+O2(g) △H3 K3
根据盖斯定律,将③-2×②,整理可得①:2H2O(g)![]() O2(g)+2H2(g),所以三个反应的反应热关系式为:△H1=△H3-2△H2;
O2(g)+2H2(g),所以三个反应的反应热关系式为:△H1=△H3-2△H2;
K1=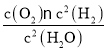 ,K2=
,K2=![]() ,则K22=
,则K22=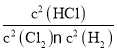 ,K3=
,K3=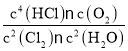 ,
,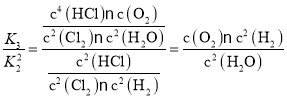 =K1;
=K1;
II.(1)反应FeO(s)+CO(g)![]() Fe(s)+CO2(g)的化学平衡常数表达式K=
Fe(s)+CO2(g)的化学平衡常数表达式K=![]() ;
;
(2)该反应的正反应是吸热反应,升高温度,化学平衡正向移动,则该反应的平衡常数K值将增大,固体由FeO变为Fe,所以生成的固体铁的质量会比原来氧化亚铁的质量少;
(3)1100℃时测得高炉中c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,,浓度商Qc=![]() =0.25<K=0.263,说明反应正向进行,反应未达到平衡,因此v(正)>v(逆);
=0.25<K=0.263,说明反应正向进行,反应未达到平衡,因此v(正)>v(逆);
(4)平衡常数只受温度影响,温度不变,则反应的平衡常数不变,因此保持高炉温度为1100 ℃,向高炉中补充大量的空气,重新达到平衡后,该反应的平衡常数K=0.263。


科目:高中化学 来源: 题型:
【题目】化学反应A2+B2=2AB的能量变化如下图所示,则下列说法不正确的是( )
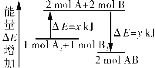
A.该反应是放热反应
B.断裂2 mol A—B键需要吸收![]() kJ的能量
kJ的能量
C.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
D.断裂1 mol A-A键和1 mol B-B键能吸收![]() kJ的能量
kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)![]() 2NH3(g),一种工业合成氨,进而合成尿素的的简易流程图如下:
2NH3(g),一种工业合成氨,进而合成尿素的的简易流程图如下:
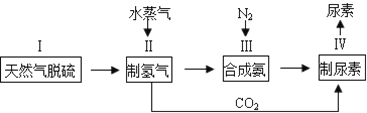
(1)步骤II中制氢气原理如下:
CH4(g)+H2O(g)![]() CO(g)+3H2(g) CO(g)+H2O(g)
CO(g)+3H2(g) CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
恒容容器中,对于以上反应,能加快反应速率的是_____________。
a. 升高温度 b. 充入He c. 加入催化剂 d. 降低压强
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为______________。
(3)CO2和H2在高温、高压、催化剂条件下可合成CH3CH2OH,反应的化学方程式_________________________________。以CH3CH2OH、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池,该电池中负极上的电极反应式是:_________________________。
(4)已知尿素的结构简式为![]() ,请写出尿素的同分异构体中含有离子键的化学式_________。
,请写出尿素的同分异构体中含有离子键的化学式_________。
(5)已知CO2+ 2NH3![]() CO(NH2)2+ H2O,若合成尿素的流程中转化率为80%时,100吨甲烷为原料能够合成__________吨尿素。
CO(NH2)2+ H2O,若合成尿素的流程中转化率为80%时,100吨甲烷为原料能够合成__________吨尿素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,![]() 某一元酸HA在水中有
某一元酸HA在水中有![]() 发生电离,下列叙述不正确的是
发生电离,下列叙述不正确的是![]()
①该溶液的![]() ;
;
②升高温度,溶液的pH增大;
③此酸的电离平衡常数约为![]() ;
;
④加水稀释后,各离子的浓度均减小;
⑤由HA电离出的![]() 约为水电离出的
约为水电离出的![]() 的
的![]() 倍;
倍;
⑥适当增大HA的浓度,HA的电离平衡正向移动,电离平衡常数增大。
A.②④⑥B.①④⑤C.②⑤⑥D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应X2(g)+Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A. Z为0.2 mol·L-1 B. Y2为0.35 mol·L-1
C. X2为0.3 mol·L-1 D. Z为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+B![]() C(g)+D,达到平衡时,下列说法不正确的是
C(g)+D,达到平衡时,下列说法不正确的是
A.若B是气体,增大A的浓度会使B的转化率增大
B.若增大A的浓度,平衡体系颜色加深,D不一定是有颜色的气体
C.升高温度,C质量分数减少,说明正反应为放热反应
D.增大压强,平衡不移动,说明B、D一定是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表中短周期的一部分。已知a原子的最外层电子数比次外层电子数少3,下列说法中不正确的是
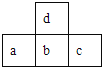
A. 元素c的含氧酸一定是强酸
B. 元素a、d的原子半径:a>d
C. 元素b在自然界中存在游离态
D. 元素b、c的阴离子半径:b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某三元羧酸H3A在表面活性剂、洗涤剂、润滑剂等方面具有重要的地位。常温时,向10mL0.01mol·L-1的H3A溶液中滴入0.01mol·L-1的NaOH溶液,H3A、H2A-、HA2-、A3-的物质的量分数与溶液的pH的关系如图所示。则下列说法中错误的是( )

A.常温时,0.01mol·L-1的H3A溶液的pH介于2~3之间
B.常温时,反应A3-+H2O ![]() HA2-+OH-的平衡常数为K=10c-14
HA2-+OH-的平衡常数为K=10c-14
C.若b=7,则将等物质的量的NaH2A与Na2HA加入到适量蒸馏水中使其完全溶解,则所得的溶液的pH一定等于7
D.加入NaOH溶液的体积为30mL时,所得溶液中存在有:c(OH-)=3c(H3A)+2c(H2A-)+c(HA2-)+c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com