
| A. | -OH与 都表示羟基 都表示羟基 | B. | 如图是食盐晶体的晶胞 | ||
| C. | CH4分子的球棍模型: | D. | 次氯酸分子的电子式: |
科目:高中化学 来源: 题型:选择题
| A. | 2 mol/L | B. | 1.8 mol/L | C. | 1.9 mol/L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
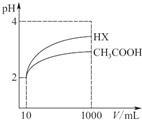 请根据下表,回答下列问题:(数据均在25℃时测定)
请根据下表,回答下列问题:(数据均在25℃时测定)| 化学式 | CH3COOH | H2CO3 | HClO | Cu(OH)2 |
| 相关常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 | Ksp=2×10-20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
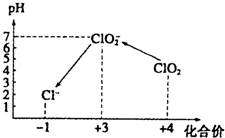 ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O | |
| C. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O | |
| D. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
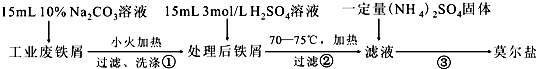
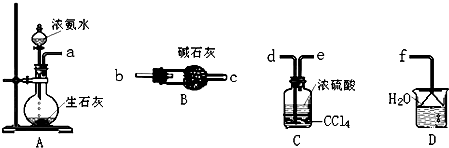

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
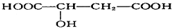 ,苹果酸可能发生的反应是( )
,苹果酸可能发生的反应是( )| A. | ①②③ | B. | ①②③④ | C. | ①②③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com