
| 规定序号 | 待测体积/mL | 盛装标准滴定管的起点读数/mL | 盛装标准滴定管的终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
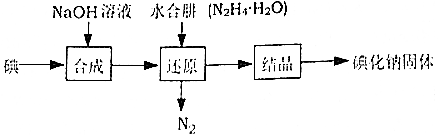
分析 用水合肼(N2H4•H2O)还原法制取碘化钠固体:加入氢氧化钠,碘和氢氧化钠发生反应:3I2+6NaOH=5NaI+NaIO3+3H2O,加入水合肼得到氮气与NaI,即发生反应:3N2H4•H2O+2NaIO3=2NaI+3N2↑+9H2O,得到的NaI溶液经蒸发浓缩、冷却结晶可得到NaI,
(1)合成NaI中可能混有NaIO3,为促使反应向生成物方向移动,生产过程中要适当补充NaOH;
(2)温度低,化学反应速率慢;N2H4•H2O的氧化产物为N2和H2O,而用Na2S或Fe屑还原会得到其它杂质;
(3)加入淀粉溶液,加盐酸酸化,若含有IO3-,会与I-反应生成I2,淀粉遇碘变蓝色;
(4)①依据盐类水解分析判断,Na2S2O3为强碱弱酸盐;检验淀粉遇碘变蓝色分析;
②检验淀粉遇碘变蓝色分析,滴定终点观察到的现象为溶液由浅蓝色褪色,且半分钟内不变色;
③根据滴定消耗的Na2S2O3的量结合方程式计算;
④考虑碘离子可能被氧化;
(5)碘化钠固体应避光密封保存.
解答 解:①碘和氢氧化钠发生反应:3I2+6NaOH=5NaI+NaIO3+3H2O,则NaI中可能混有NaIO3,为促使反应向生成物方向移动,生产过程中要适当补充NaOH;
故答案为:NaIO3;促使反应向生成物方向移动;
(2)在还原过程中,为了防止水合肼(N2H4•H2O)高温分解,反应温度控制在60~70℃,温度也不能过低,温度过低,降低化学反应速率; N2H4•H2O的氧化产物为N2和H2O,而用Na2S或Fe屑还原会得到其它杂质,水合肼还原法制得的产品纯度更高;
故答案为:温度过低,降低化学反应速率; N2H4•H2O的氧化产物为N2和H2O,不引入杂质;
(3)检验还原液中是否含有IO3-的实验方案:取适量还原液,加入淀粉溶液,加稀硫酸酸化,若溶液变蓝色,说明废水中含有IO3-;若溶液不变蓝,说明废水中不含IO3-;
故答案为:取适量还原液,加入淀粉溶液,加稀硫酸酸化,若溶液变蓝色,说明废水中含有IO3-;若溶液不变蓝,说明废水中不含IO3-;
(4)①Na2S2O3为强碱弱酸盐,因为硫代硫酸根离子水解,Na2S2O3溶液呈弱碱性,所以滴定时Na2S2O3溶液应放在碱性滴定管中;因为淀粉遇碘变蓝色,所以检验碘单质用淀粉试液作指示剂;
故答案为:碱式滴定管;淀粉;
②加入A物质为淀粉试液,滴定终点观察到的现象为溶液由蓝色褪色,且半分钟内不变色;
故答案为:溶液蓝色褪去,且半分钟内不恢复;
③根据表格3次消耗Na2S2O3的体积,取其平均值为24.00ml,又2Fe3++2I-═2Fe2++I2,2Na2S2O3+I2═Na2S4O2+2NaI所以2I-~2Na2S2O3,则样品中NaI的含量为:$\frac{24×1{0}^{-3}×0.1000×150×\frac{250}{25}}{4.000}×100%$=90%;
故答案为:90%;
④部分NaI被空气中O2氧化,用上述方法测得NaI的含量偏低;
故答案为:部分NaI被空气中O2氧化;
(5)碘化钠固体应避光密封保存,故用棕色瓶遮光、密封保存;
故答案为:用棕色瓶遮光、密封保存.
点评 本题考查物质制备实验,明确制备流程中发生的反应是解题关键,注意对题目信息的提取应用,题目综合性较强,要求学生要有扎实的实验基础知识和灵活应用信息、基础知识解决问题的能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 能在水溶液或熔融状态下导电的物质是电解质 | |
| B. | 电离出氢离子的化合物是酸 | |
| C. | 氧化还原反应中转移电子数等于得电子数与失电子数加和 | |
| D. | 丁达尔效应可用来区别溶液和胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2使品红溶液褪色 | B. | 氯水使紫色石蕊试液褪色 | ||
| C. | SO2使高锰酸钾溶液褪色 | D. | 活性炭使比墨水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①不变浑浊,②变浑浊 | B. | ①变浑浊,②不变浑浊 | ||
| C. | ①变浑浊,②变浑浊 | D. | ①不变浑浊,②变浅黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
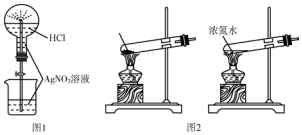
| A. | 用图1所示的装置做喷泉实验时观察到产生白色喷泉 | |
| B. | 如图2所示的两套装置均可制备NH3(不考虑净化和收集) | |
| C. | 称取2.5gCuSO4•5H2O,放入100mL容量瓶中,配制0.10mol•L-1CuSO4溶液 | |
| D. | 除去NaHSO3溶液中的Na2SO3,可加入Ba(OH)2溶液后过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com