
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。

请回答下列问题:
(1)上述流程脱硫实现了____(选填下列字母编号)。
A.废弃物的综合利用
B.白色污染的减少
C.酸雨的减少
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原因是________________________________。
(3)已知:25 ℃、101 kPa时,
Mn(s)+O2(g)===MnO2(s) ΔH=-520 kJ/mol
S(s)+O2(g)===SO2(g) ΔH=-297 kJ/mol
Mn(s)+S(s)+2O2(g)===MnSO4(s)
ΔH=-1065 kJ/mol
SO2与MnO2反应生成无水MnSO4的热化方程式是____________________________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是________________________________。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是________________。
(6)假设脱除的SO2只与软锰矿浆中的MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2________kg。
(1)A、C
(2)消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀
(3)MnO2(s)+SO2(g)===MnSO4(s)
ΔH=-248 kJ/mol
(4)Mn2++2H2O-2e-===MnO2+4H+
(5)MnO2+H2O+e-===MnO(OH)+OH-
(6)
[解析] (1)脱硫的目的是减少产生SO2,进而减少酸雨的产生,同时可对废弃物综合利用。则A、C项符合题意。(2)加入MnCO3消耗溶液中的H+,促使Al3+和Fe3+的水解平衡正向移动,生成氢氧化物沉淀除去。(3)将已知3个热化学方程式依次编号为①②③,根据盖斯定律,可知:MnO2(s)+ SO2 (g)===MnSO4(s) ΔH=③-(①+②)=-248 kJ/mol。(4)电解池中阳极失去电子发生氧化反应,则用惰性电极电解MnSO4溶液可制得MnO2,则阳极是Mn2+放电,其阳极电极反应式为Mn2++2H2O-2e-===MnO2 + 4H+。(5)原电池中正极得到电子发生还原反应,在碱性锌锰电池放电时,正极是二氧化锰得到电子,则正极电极反应式为MnO2+H2O+e-===MnO(OH)+OH-。(6)KMnO4与MnSO4反应生成MnO2的质量为c kg,根据氧化还原反应化合价升降法配平的关系式为:
2KMnO4+3MnSO4~5MnO2
3 mol 5 mol
x  mol
mol
求得:x=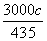 mol(MnSO4总的物质的量)
mol(MnSO4总的物质的量)
MnO2+ SO2 === MnSO4
1 mol 1 mol
 mol y
mol y
求得:y=0.4ab mol
除去铁、铝、铜、镍等杂质时,所引入的锰相当于MnO2的物质的量=x-y=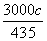 mol-0.4ab mol,则所引入的锰相当于MnO2的质量=(
mol-0.4ab mol,则所引入的锰相当于MnO2的质量=(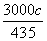 mol-0.4ab mol)×
mol-0.4ab mol)× =
= kg。
kg。


科目:高中化学 来源: 题型:
下列有关实验装置进行的相应实验,能达到实验目的的是
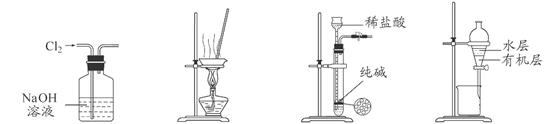
图1 图2 图3 图4
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
运用相关化学知识进行判断,下列结论错误的是( )
A.某吸热反应能自发进行,因此该反应是熵增反应
B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与社会、生活密切相关。对下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A. | 用热的纯碱溶液洗去油污 | Na2CO3可直接与油污反应 |
| B. | 源白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| C. | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与HN4Cl反应生成氨气会降低肥效 |
| D. | FeCl3溶液可用于铜质印刷线路板制作 | FeCl3能从含Cu2+的溶液中置换出铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.【查阅资料】
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀盐酸。
Ⅱ.【制备产品】
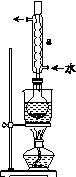
实验装置如图所示(省略夹持装置):

实验步骤:
(1)检查装置气密性,如图示加入试剂。
仪器a的名称是________;E中的试剂是________(选填下列字母编号)。
A.稀H2SO4
B.NaOH溶液
C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3的混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中的混合物,滤液经________(填写操作名称)、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.【探究与反思】
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,____________________________________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了改进,改进后的操作是______________________________________________________________________________。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过________方法提纯。
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3(aq)+S(s)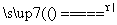 Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是__________________________。
(2)仪器a的名称是________,其作用是____________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________。检验是否存在该杂质的方法是____________________________。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:________________________________________________________________________
________________________________________________________________________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O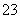 +I2===S4O
+I2===S4O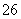 +2I-
+2I-
(5)滴定至终点时,溶液颜色的变化:____________________________________________。
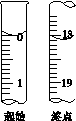
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为__________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
Ⅲ.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO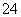 ,常用作脱氯剂,该反应的离子方程式为____________________________________________。
,常用作脱氯剂,该反应的离子方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除杂方案错误的是( )
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A. | CO(g) | CO2(g) | NaOH溶液、 浓H2SO4 | 洗气 |
| B. | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
| C. | Cl2(g) | HCl(g) | 饱和食盐水、 浓H2SO4 | 洗气 |
| D. | Na2CO3(s) | NaHCO3(s) | — | 灼烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用内置有螺旋状铜丝的胶头滴管小心吸取一滴管浓硝酸后迅速插入细口瓶中(如图K121),滴管与瓶口接触处垫一小块滤纸使滴管与瓶口留少量空隙,依次观察到如下现象:①滴管内产生红棕色气体,液面下降;②滴管内的液面上升,气体变成无色;③滴管内的液面再次下降。下列说法中不正确的是( )
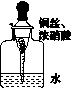
图K121
A.现象①中产生的红棕色气体为NO2
B.产生现象②的原因是NO2与水反应
C.产生现象③的原因是铜与稀硝酸反应
D.最终瓶内溶液中的溶质一定只有Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B.2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
C.加热0.1 mol·L-1Na2CO3溶液,CO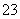 的水解程度和溶液的pH均增大
的水解程度和溶液的pH均增大
D.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com