
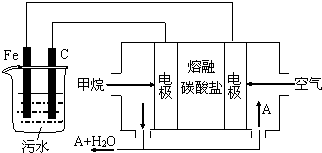
| A. | 该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,则负极的电极反应是CH4+4CO32--8e-═5CO2+2H2O | |
| B. | 实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣,此时,可以向污水中加入适量的稀H2SO4 | |
| C. | 实验过程中,若阴极产生2mol气体,则燃料电池消耗11.2L CH4 | |
| D. | 为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A参加循环,则A物质是CO32- |
分析 燃料电池中,正极发生的反应是氧气得电子被还原的过程,负极发生的反应是燃料失电子被氧化的过程;电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳,甲烷燃料电池中,负极发生的反应是甲烷失电子被氧化的过程,电极反应式为CH4+4CO32--8e-=5CO2+2H2O,所以电解时铁作阳极,因此主要发生Fe-2e-=Fe2+,阴极上氢离子得电子生成氢气,据此分析.
解答 解:A、甲烷燃料电池中,负极发生的反应是甲烷失电子被氧化的过程,电极反应式为CH4+4CO32--8e-=5CO2+2H2O,故A正确;
B、沉降的原理是碱性环境下,让铁离子沉淀,若加入硫酸,则铁离子不会产生沉淀,无法达到实验目的,故B错误;
C、电解时阴极反应式为2H++2e-=H2↑,产生4.48 L气体为标准状况下时,转移电子数为0.2mol,甲烷燃料电池中,负极发生的反应是甲烷失电子被氧化的过程,电极反应式为CH4+4CO32--8e-=5CO2+2H2O,则燃料电池消耗$\frac{0.2}{8}$×22.4L=0.56LCH4,故C错误;
D、电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳,使该燃料电池长时间稳定运行,电池工作时必须 有部分A物质参加循环.A物质是CO2,故D错误;
故选A.
点评 本题考查原电池和电解池的知识,较为综合,做题时注意利用守恒的思考去解答,同时注意电极反应式的书写.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:S>O>N | B. | 沸点:H2O>HF>H2S | ||
| C. | 离子半径:Cl->Al3+>Mg2+ | D. | 还原性:I->S2->Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ①③④⑤⑥ | C. | ②③⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C和14C属于同一种元素,它们互为同位素 | |
| B. | LiH、LiD、LiT的摩尔质量之比为8:9:10 | |
| C. | 两原子如果核外电子排布相同,则一定属于同种元素 | |
| D. | 阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 对于可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时C的百分含量与温度(T)和压强(P)关系如图所示,下面叙述正确的是( )
对于可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时C的百分含量与温度(T)和压强(P)关系如图所示,下面叙述正确的是( )| A. | 使用催化剂,C的百分含量增大 | |
| B. | 升温,化学平衡向正反应方向移动 | |
| C. | 化学方程式的化学计量数关系m+n>e+f | |
| D. | 该反应是一个放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com