
【题目】下列有关说法正确的是
A.1 mol Cl2参加反应转移电子数一定为2NA
B.在反应KIO3 + 6HI = KI + 3I2 +3H2O中,每生成3 mol I2转移的电子数为6NA
C.根据反应中HNO3(稀)![]() NO,而HNO3(浓)
NO,而HNO3(浓)![]() NO2可知,氧化性:HNO3(稀) > HNO3(浓)
NO2可知,氧化性:HNO3(稀) > HNO3(浓)
D.含有大量NO3-的溶液中,不能同时大量存在H+、Fe2+、Cl-
【答案】D
【解析】
A选项,在氯气与氢氧化钠反应中,1 mol Cl2参加反应转移电子数为NA,故A错误;
B选项,在反应KIO3 + 6HI = KI + 3I2 +3H2O中,碘元素化合价由+5价和-1价变化为0价,电子转移5mol,生成3mol碘单质,所以每生成3 mol I2转移电子数为5NA,故B错误;
C选项,不能根据还原产物的价态确定氧化剂氧化性的强弱,实际上氧化性:HNO3(稀) < HNO3(浓),故C错误;
D选项,酸性条件下NO3-具有强氧化性,能氧化Fe2+,所以含有大量NO3-的溶液中,不能同时大量存在H+、Fe2+、Cl-,故D正确。
综上所述,答案为D。


科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.用排饱和食盐水法收集Cl2
B.加压有利于合成氨反应
C.冰镇的啤酒打开后泛起泡沫
D.对2HI![]() H2+I2(g)平衡体系增加压强使颜色变深
H2+I2(g)平衡体系增加压强使颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,甲是利用微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中错误的是( )

A.乙装置中溶液颜色不变
B.铜电极应与Y相连接
C.M电极反应式:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+
D.当N电极消耗0.25mol气体时,铜电极质量减少16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环氧树脂因其具有良好的机械性能、绝缘性能以及与各种材料的粘结性能,已广泛应用于涂料和胶黏剂等领域。下面是制备一种新型环氧树脂G的合成路线:
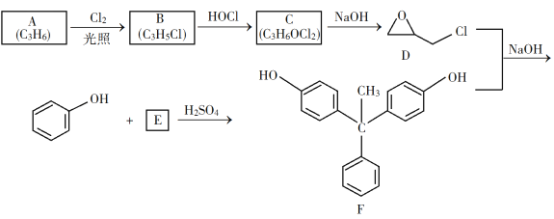

已知以下信息:
①
② ③
③
回答下列问题:
(1)A是一种烯烃,化学名称为__________,C中官能团的名称为_________、_________。
(2)由B生成C的反应类型为_________。
(3)由C生成D的反应方程式为__________________。
(4)E的结构简式为__________________。
(5)E的二氯代物有多种同分异构体,请写出其中能同时满足以下条件的芳香化合物的结构简式__________、_________。
①能发生银镜反应;②核磁共振氢谱有三组峰,且峰面积比为3∶2∶1。
(6)假设化合物D、F和![]() 恰好完全反应生成
恰好完全反应生成![]() 单一聚合度的G,若生成的
单一聚合度的G,若生成的![]() 和
和![]() 的总质量为
的总质量为![]() ,则G的n值理论上应等于__________。
,则G的n值理论上应等于__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分等电子体类型、代表物质及对应的空间构型如表所示:
等电子类型 | 代表物质 | 空间构型 |
四原子24电子等电子体 | SO3 | 平面三角形 |
四原子26电子等电子体 | SO32- | 三角锥形 |
五原子32电子等电子体 | CCl4 | 四面体形 |
六原子40电子等电子体 | PCl5 | 三角双锥形 |
七原子48电子等电子体 | SF6 | 八面体形 |
请回答下列问题。
(1)请写出下列离子的空间构型:
![]() ____________________,
____________________,![]() ____________________,
____________________,![]() ____________________。
____________________。
(2)由第2周期元素原子构成,与F2互为等电子体的离子是__________。
(3)![]() 的空间构型如图1所示,请再按照图1的表示方法在图2中表示出
的空间构型如图1所示,请再按照图1的表示方法在图2中表示出![]() 分子中O、S、F原子的空间位置。已知
分子中O、S、F原子的空间位置。已知![]() 分子中O、S间为共价双键,S、F间为共价单键。__________。
分子中O、S间为共价双键,S、F间为共价单键。__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是

A. WZ的水溶液呈碱性
B. 元素非金属性的顺序为X>Y>Z
C. Y的最高价氧化物的水化物是中强酸
D. 该新化合物中Y不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)盐酸中加入少量K2FeO4固体,产生黄绿色气体。该反应的化学方程式是___。
(2)用NaClO-NaOH溶液氧化AgNO3,制得高纯度的纳米级Ag2O2。写出该反应的离子方程式:___。
(3)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:___。
(4)Cl2与热的NaOH溶液反应生成NaClO3,该反应的离子方程式为___。
(5)在酸性条件下,NaHSO3使Cr2O72-还原成为Cr3+,写出该反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关苯分子的说法不正确的是( )
A.苯分子中![]() 原子采用
原子采用![]() 杂化,形成夹角为
杂化,形成夹角为![]() 的三个
的三个![]() 杂化轨道
杂化轨道
B.每个碳原子有一个与碳环平面垂直的未参与杂化的![]() 轨道,以“肩并肩”方式相互重叠,形成大
轨道,以“肩并肩”方式相互重叠,形成大![]() 键
键
C.苯分子中最多有六个原子共面,六个碳碳键完全相同
D.苯分子中的大![]() 键可表示为
键可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是__。
A.KMnO4 B.H2O2 C.Cl2水 D.HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的__。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,已知Ksp(AmBn)=[c(An+)]m.[c(Bm-)]n,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为__,Fe3+完全沉淀时溶液的pH为__,通过计算确定上述方案__(填“可行”或“不可行”)。(提示:lg2=0.3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com