
分析 HNO3为反应物,具有强氧化性,则N2O为生成物,反应中硝酸被还原,为氧化剂,则反应中FeSO4应为还原剂,被氧化生成Fe(NO3)3和Fe2(SO4)3,根据得失电子守恒以及元素守恒书写方程式.
解答 解:氧化还原反应的特征为化合价的升降,反应中HNO3为反应物,具有强氧化性,则N2O为生成物,反应中硝酸被还原,为氧化剂,题给物质中元素化合价发生变化的还有Fe,则Fe元素化合价应升高,被氧化,则FeSO4应为还原剂,被氧化生成Fe(NO3)3和Fe2(SO4)3,根据电子守恒,氮元素的化合价降低了4价,铁元素化合价升高了1价,根据得失电子守恒以及元素守恒,最小公倍数为24,所以硫酸亚铁前边系数是24,硝酸前系数是,30,水的前边系数是15,化学方程式为:30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+3N2O↑+15H2O,
故答案为:30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+3N2O↑+15H2O.
点评 本题综合考查氧化还原反应,为高考常见题型,侧重于学生的分析能力考查,注意从元素化合价的角度分析氧化还原反应的相关概念和物质的性质,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 2-丁烯与HBr发生加成反应 | |
| B. | 3-氯戊烷与NaOH乙醇溶液共热发生消去反应 | |
| C. | 甲苯在一定条件下发生溴代反应生成一溴代甲苯的反应 | |
| D. | 邻羟基苯甲酸与NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | ① | ② | ③ | ④ |
| 装置 |  |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体 | |
| B. | 用向上排空气法收集铜粉与稀硝酸反应产生的NO | |
| C. | 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 | |
| D. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:ClO->I2>SO42- | |
| B. | 蓝色消失的原因是Na2SO3溶液反应生成SO2具有漂白性 | |
| C. | 淀粉KI溶液变蓝是因为I-被ClO-氧化为I2,I2遇淀粉变蓝 | |
| D. | 若将Na2SO3溶液加入溴水,溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
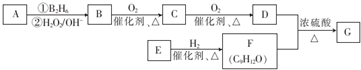
 ;该反应的反应类型为取代反应或酯化反应
;该反应的反应类型为取代反应或酯化反应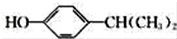 .
.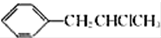 为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):
为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):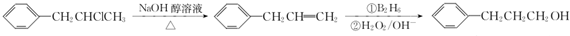 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com