
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件多化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下的方案。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/ molL-1 | 体积/mL | 浓度/ molL-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,标况下,每生成89.6L CO2气体,转移 mol 电子。写出H2C2O4与酸性KMnO4溶液反应的离子方程式:
(2)探究温度对化学反应速率影响的实验编号是 (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是 。本实验通过测定 来判断反应的快慢。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______________ molL-1min-1。
【答案】(1)2MnO4-+5H2C2O4+6H+ =2Mn2+ +10CO2↑+8H2O
(2)②和③, ①和② 溶液褪色所需时间 (3)0.01
【解析】
试题分析:(1)根据反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,利用化合价升降相等写出反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑;
(2)探究温度对化学反应速率影响,必须满足除了温度不同,其他条件完全相同,所以满足此条件的实验编号是:②和③;探究反应物浓度对化学反应速率影响,除了浓度不同,其他条件完全相同的实验编号是①和②;本实验通过测定溶液褪色所需时间来判断反应的快慢。
(3)草酸的物质的量为:0.10molL-1×0.002L=0.0002mol,高锰酸钾的物质的量为:0.010molL-1×0.004L=0.00004mol,草酸和高锰酸钾的物质的量之比为:0.0002mol:0.00004mol=5:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:(0.010mol/L×0.004L)÷(0.002L+0.004L)=![]() ×0.010mol/L,这段时间内平均反应速率v(KMnO4)=
×0.010mol/L,这段时间内平均反应速率v(KMnO4)=![]() ×0.010mol/L÷(40/60min)=0.010molL-1min-1。
×0.010mol/L÷(40/60min)=0.010molL-1min-1。


科目:高中化学 来源: 题型:
【题目】氮是一种重要的元素,其对应化合物在生产生活中有重要的应用。
(1)氮化铝(AlN)可用于制备耐高温的结构陶瓷,遇强碱会腐蚀,写出AlN与氢氧化钠溶液反应的离子方程式_______________。
(2)氨是制备氮肥、硝酸等的重要原料②③
①己知:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
N2(g)+O2(g) ![]() 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
2H2(g)+O2(g) ![]() 2H2O(1) △H= -571.6 kJ/mol
2H2O(1) △H= -571.6 kJ/mol
试写出表示氨的标准燃烧热的热化学方程式________________。
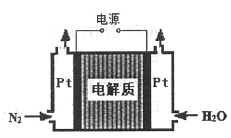
②某电解法制氨的装置如右图所示,电解质只允许质子通过,试写出阴极的电极反应式__________。
(3)反应:2NO(g)+O2(g)![]() 2NO2(g)△H<0是制备硝酸过程中的一个反应。
2NO2(g)△H<0是制备硝酸过程中的一个反应。
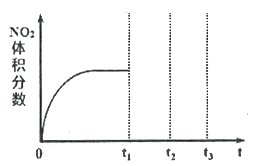
①将NO和O2按物质的量之比为2:1置于恒温恒容密闭容器中进行上述反应,得到NO2体积分数与时间的关系如下图所示。保持其它条件不变,t1时再向容器中充入适量物质的量之比为2:1的NO和O2的混合气体,t2时再次达到平衡,请画出tl-t3时间范围内NO2体积分数随时间的变化曲线:____________。
②在研究此反应速率与温度的关系时发现,NO转化成NO2的速率随温度升高反而减慢。进一步研究发现,上述反应实际是分两步进行的:
I 2NO(g) ![]() N2O2(g) △H<0
N2O2(g) △H<0
II N2O2(g)+O2(g) ![]() 2NO2(g) △H<0
2NO2(g) △H<0
已知反应I能快速进行,试结合影响化学反应速率的因素和平衡移动理论分析,随温度升高,NO转化成NO2的速率减慢的可能原因________。
(4)已知常温下,Ka(CH3COOH)=Kb(NH3·H2O)=l.8×l0-5。则常温下0.lmol/L的CH3COONH4溶液中,(CH3COO-):c(NH3·H2O)=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某50 mL溶液中可能含有H+、Na+、Mg2+、Al3+、SO42-、NH4+离子,当向该溶液中加入5 mol/L的NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积v(NaOH)变化关系如下图所示。
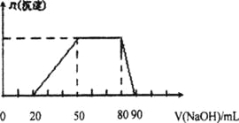
A.原溶液中一定含有的阳离子是H+、Mg2+、Al3+、SO42-
B. 原溶液中Al3+的浓度为lmol/L
C. 原溶液中NH4+的物质的量为0.4 mol
D. 当加入的NaOH溶液的体积为90mL时,反应后溶液中的离子只有Na+和SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是( )
2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n molNO2
②用NO2、NO、O2的物质的量浓度变化表示的反应速率比为2∶2∶1的状态
③混合气体的颜色不再改变的状态
④混合气体的密度不再改变的状态
⑤混合气体的平均摩尔质量不再改变的状态
⑥混合气体的压强不再改变的状态
A. ①②③④ B. ③④⑤⑥ C. ①③⑤⑥ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池具有广阔的发展前途,科学家近年研制出一种微型的燃料电池,采用甲醇取代氢气做燃料可以简化电池设计,该电池有望取代传统电池.某学生在实验室利用碱性甲醇燃料电池电解Na2SO4溶液.
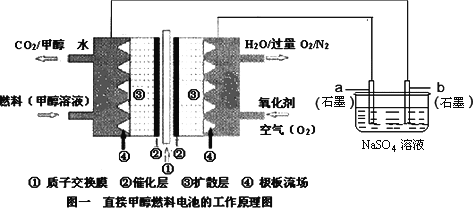
请根据图示回答下列问题:
(1)图中a电极是_____________(填“正极”、“负极”、“阴极”或“阳极”).该电极上发生的电极反应式为__________________.
(2)碱性条件下,通入甲醇的一极发生的电极反应式为________________.
(3)当消耗3.36 L氧气时(已折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是____________mol.
(4)若a、b电极材料分别为铁和石墨,则电解总反应化学方程式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为2L的恒温恒容密闭容器中充入2mol SO2和1mol O2,发生反应2SO2(g)+O2(g) ![]() 2SO3(g) △H=-Q kJ·mol-l (Q>O),下列有关说法不正确的是
2SO3(g) △H=-Q kJ·mol-l (Q>O),下列有关说法不正确的是
A. 反应达到平衡时,放出热量为QkJ
B. 若容器的压强不再发生交化,则反应达到平衡
C. 反应过程中c(SO2)+ c(SO3)=1 mol·L-1恒成立
D. 平衡时,SO2、O2的转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.减少交通事故除遵守交通法规正确驾驶外,安全措施也极为重要。汽车的安全气嚢内有叠氮化钠(NaN3)与硝酸铵(NH4NO3)等物质。当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解反应,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全。
请回答下列问题:
(1)下列判断正确的是_______
A.道路起雾与H2O分子的化学键断裂有关
B.NH4NO3中只含有极性共价键
C.NaN3受到猛烈撞击时化学键一定断裂
D.NaN3、NH4NO3均属于离子化合物
(2)汽车的安全气囊内叠氮化钠爆炸过程中的能量变化如图所示:

①叠氮化钠的爆炸反应属于_______(填“吸热”或“放热”)反应。
②若爆炸过程中有18mol 非极性键生成(一个共用电子对为一个化学健),则反应的能量变化为______kJ,消耗叠氮化钠的质量为_________g。
③若安全气嚢的体积为VL,NaN3的爆炸在ts内完成,反应过程中消耗292.5g NaN3,则用N2表示的反应速率为____________。
II.(3)已知X、Y、Z、W分别是元素周期表中的短周期元素,且原子序数依次增大。X、W为同主族元素,Y、Z为同周期的相邻元素。W原子的质子数等子Y、Z原子的最外层电子数之和。Y与X形成的分子中含有3个共价键,X、Y、Z所形成的常见化合物是汽车安全气囊中的一种填充物。请回答下列问题:
①写出X、Y、W形成化合物的电子式___________。
②一定温度下,X2、Y2在容积为5L的密闭容器中发生可逆反应,充入的X2和Y2的物质的量分别是6mol和3mol,达到化学平衡状态时生成物的物质的量为2.4mol。达到化学平衡状态时,混合气体中Y2的体积分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法中,正确的是( )
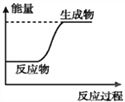
A. 等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量少
B. 如图可表示C和H2O(g)反应过程中的能量变化
C. 吸热反应一定要加热,才能进行
D. 已知中和热为57.3 kJ·mol-1,则浓硫酸与NaOH溶液反应生成 1mol H2O时, 共放出57.3 kJ的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com