
| A. | 用纯净的乙烯合成的聚乙烯是纯净物 | |
| B. | 聚乙烯可以人工合成,也可以是天然高分子化合物 | |
| C. | 聚乙烯高温分解,生成其单体--乙烯 | |
| D. | 聚乙烯的单体能够使溴的四氯化碳溶液褪色 |
科目:高中化学 来源: 题型:解答题
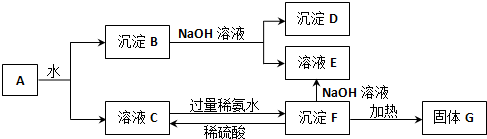
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
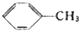 $→_{△}^{KMnO_{4}}$
$→_{△}^{KMnO_{4}}$ $\stackrel{HCl}{→}$
$\stackrel{HCl}{→}$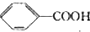
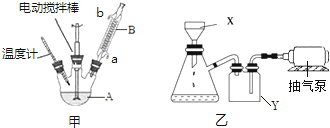
| 名称 | 相对分子质量 | 性状 | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 92 | 无色液体、易燃、易挥发 | -95 | 110.6 | 不溶 | 互溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 112.4(100℃升华) | 248 | 微溶 | 易溶 |
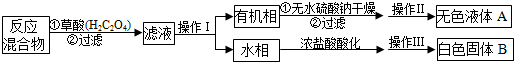
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砷元素的最高化合价为+3 | B. | 砷元素是第四周期的主族元素 | ||
| C. | 砷原子的次外层上有8个电子 | D. | 砷的氧化物的水化物是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与H2化合时,X单质比Y单质容易 | |
| B. | X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 | |
| C. | X原子的原子序数比Y原子的原子序数大 | |
| D. | X单质可以把Y从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
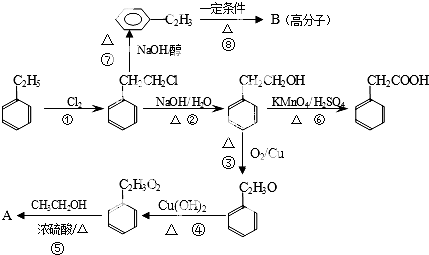
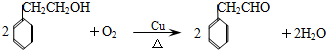
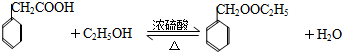
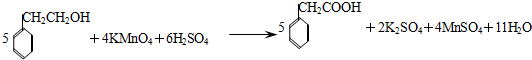

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2>HI>H2SO3 | B. | HI>FeCl2>H2SO3 | C. | H2SO3>HI>FeCl2 | D. | FeCl2>H2SO3>HI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com