
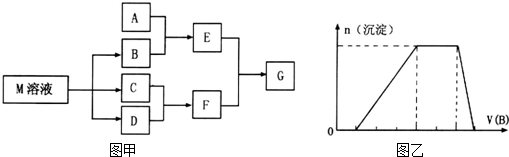

分析 (1)C可在D中燃烧发出苍白色火焰,为氢气与氯气反应生成HCl,可推知C为H2、D为Cl2、F为HCl,M是日常生活中不可缺少的调味品,由转化关系可知,M的溶液电解生成氢气、氯气与B,可推知M为NaCl、B为NaOH,
(2)B为NaOH,根据原子电子层数越多半径越大,电子层数相同时则核电荷数越多,半径越小,据此判断;
(3)若A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,E为Na2SiO3,与F溶液反应得到G为H2SiO3;
(4)若A是一种常见金属单质,且与NaOH溶液能够反应,则A为Al,E为NaAlO2,则将过量的HCl溶液逐滴加入NaAlO2溶液中,先生成氢氧化铝,而后氢氧化铝溶解;
(5)由图可知,开始加入NaOH没有沉淀和气体产生,则一定有H+,一定没有CO32-,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe3+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3•H2O的反应,则含有NH4+,由电荷守恒可知一定含有SO42-,根据各阶段消耗的NaOH体积结合离子方程式计算n(H+):n(Al3+):n(NH4+)之比,再结合电荷守恒计算与n(SO42-)的比例关系,据此计算;
若A是一种盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,可推知A中含有Fe2+,E为Fe(OH)3,G为FeCl3;
(6)若E可用于检验葡萄糖的存在,则E为氢氧化铜,E和F生成G,则G为氯化铜,由于铜离子能水解,氯化把易挥发,所以氯化铜溶液充分蒸发灼烧后的产物为氧化铜,氧化铜与乙醇发生氧化还原反应生成铜和乙醛,据此答题;
(7)根据图中各物质转化关系及元素守恒可写出由CO2和H2O转化为葡萄糖溶液的化学方程式.
解答 解:(1)C可在D中燃烧发出苍白色火焰,为氢气与氯气反应生成HCl,可推知C为H2、D为Cl2、F为HCl,M是日常生活中不可缺少的调味品,由转化关系可知,M的溶液电解生成氢气、氯气与B,可推知M为NaCl、B为NaOH,用惰性电极电解M溶液的离子方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
(2)B为NaOH,根据原子电子层数越多半径越大,电子层数相同时则核电荷数越多,半径越小,所以NaOH中各元素原子半径大小为Na>O>H,
故答案为:Na>O>H;
(3)若A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,E为Na2SiO3,与F溶液反应可以得到G为H2SiO3,
故答案为:H2SiO3;
(4)由图可知,开始加入NaOH没有沉淀和气体产生,则一定有H+,一定没有CO32-,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe3+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3•H2O的反应,则含有NH4+,由电荷守恒可知一定含有SO42-,
发生反应H++OH-=H2O,氢离子消耗NaOH溶液的体积为1积,
发生反应Al3++3OH-=Al(OH)3↓,铝离子消耗NaOH溶液的体积为3体积,
发生反应NH4++OH-=NH3•H2O,铵根消耗氢氧化钠为2体积,
则n(H+):n(Al3+):n(NH4+)=1:1:2,由电荷守恒可知,n(H+):n(Al3+):n(NH4+):n(SO42-)=1:1:2:3,故c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3,
故答案为:c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3;
(6)若E可用于检验葡萄糖的存在,则E为氢氧化铜,E和F生成G,则G为氯化铜,由于铜离子能水解,氯化把易挥发,所以氯化铜溶液充分蒸发灼烧后的产物为氧化铜,氧化铜与乙醇发生氧化还原反应生成铜和乙醛,反应方程式为2CH3CH2OH+CuO$\stackrel{△}{→}$2CH3CHO+Cu+2H2O,
故答案为:2CH3CH2OH+CuO$\stackrel{△}{→}$2CH3CHO+Cu+2H2O;
(7)根据图中各物质转化关系及元素守恒可写出由CO2和H2O转化为葡萄糖溶液的化学方程式为6CO2(g)+6H2O(l)$\stackrel{△}{→}$ C6H12O6(aq)+2H2O(g),
故答案为:6CO2(g)+6H2O(l)$\stackrel{△}{→}$ C6H12O6(aq)+2H2O(g).
点评 本题考查无机物推断等,题目涉及元素化合物较多,需要学生全面掌握据基础知识,注意离子方程式与电荷守恒的应用,难度中等.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:选择题

| A. | ①②④⑤ | B. | ③⑤⑥⑦ | C. | ②④⑤⑥ | D. | ①③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③⑤ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黑火药由硫黄、硝石、木炭三种物质按一定比例混合制成 | |
| B. | 可用蘸浓硫酸的棉棒检验输送氨气的管道是否漏气 | |
| C. | 碘是人体必需微量元素,所以要适量吃富含碘酸根原子团的食物 | |
| D. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 10 | 20 | 30 | 50 | 70 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 500 | 1000 | 1500 |
| n(N2O5)/mol | 5.00 | 3.5 | 2.50 | 2.50 |
| A. | 500s内N2O5分解速率为3×10-4mol•L-1•s-1 | |
| B. | 反应达平衡后,往容器中加入5molN2O5气体,平衡正向移动,反应的热效应不变 | |
| C. | 相同温度下,将体积缩小为原来的$\frac{1}{2}$,达到新平衡时,N2O5(g)的浓度为0.125mol/L | |
| D. | 达到新平衡的压强是初始时的1.75倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当反应①中v正(CH4)=v逆(CO)时,表明该反应达平衡状态 | |
| B. | 其他条件不变时,增大体系压强,反应①、②中甲烷的转化率均减小 | |
| C. | 使用高效催化剂可以加快反应速率,同时提高CH4的转化率 | |
| D. | 同一容器内同时发生反应①与②时,容器内温度可能保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铁与硫酸铜溶液反应:2Fe+3Cu2+═2Fe3++3Cu | |
| B. | 碳酸氢钠溶液与氢氧化钠溶液反应:OH-+HCO3-═H2O+CO2↑ | |
| C. | 氢氧化钡溶液与硫酸溶液反应:Ba2++2OH-+2H++SO42-═2H2O+BaSO4↓ | |
| D. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com