
常温下,0.1 mol·L-1某一元酸HA溶液中 =1×10-12,下列说法中正确的是( )
=1×10-12,下列说法中正确的是( )
A.溶液中由水电离出的c(H+)=1×10-10 mol·L-1
B.溶液中存在HA H++A-
H++A-
C.与0.1 mol·L-1 NaOH溶液等体积混合后所得溶液为中性
D.原溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 有机推断练习卷(解析版) 题型:填空题
可降解聚合物P的合成路线如下:

已知:

(R为烃基)
(1)A的含氧官能团名称是________。
(2)羧酸a的电离方程式是_______________________________________________。
(3)B→C的化学方程式是_________________________________________________。
(4)化合物D苯环上的一氯代物有2种,D的结构简式是_______________________。
(5)E→F中反应①和②的反应类型分别是________。
(6)F的结构简式是_____________________________________________________。
(7)聚合物P的结构简式是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习物质的组成分类及能量变化练习卷(解析版) 题型:实验题
某一种胃药中的抑酸剂为碳酸钙,其中所含的抑酸剂质量的测定如下:
①需配制0.1 mol·L-1的HCl溶液和0.1 mol·L-1的NaOH溶液
②取一粒(药片质量相同) 0.2 g的此胃药片,磨碎后加入20.0 mL蒸馏水
③以酚酞为指示剂,用0.1 mol·L-1的NaOH溶液滴定,用去V mL达滴定终点
④加入25 mL 0.1 mol·L-1的HCl溶液
(1)写出实验过程的步骤(写编号顺序) 。
(2)下图所示容器中配制0.1 mol·L-1的HCl溶液和0.1 mol·L-1的NaOH溶液肯定不需要的仪器是(填序号) ,配制上述溶液还需要的玻璃仪器是 (填仪器名称)。

(3)配制上述溶液应选用的容量瓶规格是(填字母) 。
A.50 mL 50 mL
B.100 mL 100 mL
C.100 mL 150 mL
D.250 mL 250 mL
(4)写出有关的化学反应方程式: 、 。
(5)每粒胃药中含碳酸钙的质量为 g。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 离子反应、氧化还原反应练习卷(解析版) 题型:选择题
爆竹的主要成分为硫黄、炭粉和硝酸钾,为了一些特殊效果还加入镁粉、铁粉、铝粉、锑粉及无机盐。下列说法中不正确的是( )
A.爆竹爆炸不宜使用水来灭火,可用干沙
B.爆竹的燃放产生大量污染气体,应加以限制
C.爆竹燃放过程中硝酸钾作氧化剂
D.爆竹爆炸过程中发生反应为2KNO3+3C+S K2S+N2↑+3CO2↑,每生成1 mol N2转移10NA个电子(NA表示阿伏加德罗常数的值)
K2S+N2↑+3CO2↑,每生成1 mol N2转移10NA个电子(NA表示阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 电解质溶液与电离平衡练习卷(解析版) 题型:选择题
向20 mL 0.5 mol·L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中错误的是( )

A.醋酸的电离平衡常数:B点>A点
B.由水电离出的c(OH-):B点>C点
C.从A点到B点,混合溶液中可能存在:c(CH3COO-)=c(Na+)
D.从B点到C点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 电化学练习卷(解析版) 题型:选择题
已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用右图所示装置电解,其中某电极增重a g,另一电极上产生标准状况下的气体V mL。下列说法正确的是( )

A.铜电极连接电源正极
B.黑色粉末X是铁粉
C.铜的相对原子质量的计算式是
D.石墨电极上发生的反应是4OH--4e- O2↑+2H2O
O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 物质结构和元素周期律练习卷(解析版) 题型:实验题
某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置(部分夹持装置已略去):
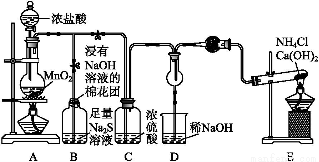
(1)写出A中反应的离子方程式 。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式 。
(3)试从原子结构角度解释氯的氧化性大于硫的原因 。
(4)D中干燥管中出现的现象及化学方程式 。
(5)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,请画出其装置图 (并注明盛装试剂)。
(6)还有什么方法能证明氧化性Cl2>S,用一种相关事实说明 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 物质结构与性质(选修3)练习卷(解析版) 题型:填空题
A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余能层均充满电子。G元素与D元素同主族,且相差3个周期。
(1)元素A、B、C的第一电离能由小到大的是 (用元素符号表示)。
(2)E的最高价含氧酸中E的杂化方式为 。
(3)F原子的外围电子排布式为 。
(4)DE,GE两种晶体,都属于离子晶体,但配位数不同,其原因是 。
(5)已知DE晶体的晶胞如图所示,若将DE晶胞中的所有E离子去掉,并将D离子全部换为A原子,再在其中的4个“小立方体”中心各放置一个A原子,且这4个“小立方体”不相邻。位于“小立方体”中的A原子与最近的4个A原子以单键相连,由此表示A的一种晶体的晶胞(已知A—A键的键长为a cm,NA表示阿伏加德罗常数的数值),则该晶胞中含有 个A原子,该晶体的密度是 g·cm-3(列式表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com