
 自然界中氮元素有多种存在形式
自然界中氮元素有多种存在形式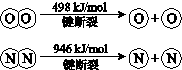
分析 (1)工业合成氨是氢气和氮气在高温高压催化剂作用下反应生成氨气,反应是可逆反应;
(2)①根据物质的键能变化计算;
②根据键能的差值,判断键的强弱;
(3)①根据反应的方向,判断正逆反应速率的大小;
②根据氨气的体积分数计算n(N2):n(NH3);
(4)水中的氧气氧化氨气生成亚硝酸和水.
解答 解:(1)工业合成氨是氢气和氮气在高温高压催化剂作用下反应生成氨气,反应是可逆反应,反应的化学方程式为:N2+3H2$?_{高温高压}^{催化剂}$2NH3,
故答案为:N2+3H2$?_{高温高压}^{催化剂}$2NH3;
(2)①根据4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1269kJ/mol,可知12H-N+3×498kJ/mol-2×946kJ/mol-12H-O=-1269kJ/mol,得(H-O)-(H-N)=72.6kJ/mol,
故答案为:72.6;
②根据(H-O)-(H-N)=72.6kJ/mol,可知H-O 键比H-N键强,
故答案为:强;
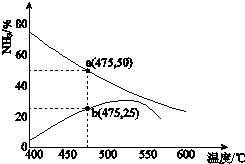
(3)①图中b点,氨气的体积分数逐渐增加,可知向正反应方向移动,正反应速率大于逆反应速率;故答案为:>;
②图中a点,设反应的N2为x,
则N2+3H2 ?2NH3
初始物质的量:1 3 0
变化的物质的量:x 3x 2x
平衡时的物质的量:1-x 3-3x 2x
氨气的体积分数为50%时,则$\frac{2x}{1-x+3-3x+2x}$=50%,解之得x=$\frac{2}{3}$,则n(N2):n(NH3)=$\frac{1}{3}$:$\frac{4}{3}$=1:4,
故答案为:1:4;
(4)水中的氧气氧化氨气生成亚硝酸和水,方程式为2NH3+3O2═2HNO2+2H2O,
故答案为:2NH3+3O2═2HNO2+2H2O.
点评 本题考查了工业合成氨、反应热的计算、化学平衡的有关计算等,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握三段式在化学平衡计算中的应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
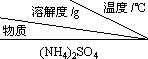 | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.3 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4•FeSO4•6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
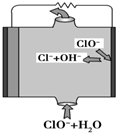 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低等特点.一般研究的镁燃料电池可分为镁空气燃料电池、镁海水燃料电池、镁过氧化氢燃料电池和镁次氯酸盐燃料电池.其中,镁次氯酸盐燃料电池的工作原理如图所示,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低等特点.一般研究的镁燃料电池可分为镁空气燃料电池、镁海水燃料电池、镁过氧化氢燃料电池和镁次氯酸盐燃料电池.其中,镁次氯酸盐燃料电池的工作原理如图所示,下列有关说法不正确的是( )| A. | 放电过程中OH-移向正极 | |
| B. | 电池的总反应式为Mg+ClO-+H2O═Mg(OH)2+Cl- | |
| C. | 镁燃料电池中镁均为负极,发生氧化反应 | |
| D. | 镁过氧化氢燃料电池,酸性电解质中正极反应式为H2O2+2H++2e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1:1 | B. | 3:2:1 | C. | 3:1:2 | D. | 4:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
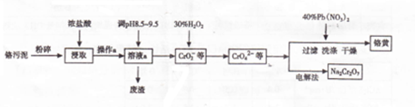
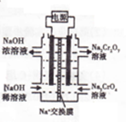
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
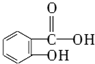 ,俗名水杨酸.
,俗名水杨酸. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现欲用纯净的锌粒与稀盐酸反应制取H2,请回答:
现欲用纯净的锌粒与稀盐酸反应制取H2,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com