
【题目】工业上以钛铁矿[主要成分为钛酸亚铁( FeTiO3),含有MgO、SiO2等杂质]为原料,制备金属钛和铁红的工艺流程如下:

已知:①酸浸时, FeTiO3转化为Fe2+和TiO2+;②本实验温度下,Ksp[Mg(OH)2]=1.0×10-11;请回答下列问题:
(1)酸浸时如何提高浸取速度和浸取率_____________________________(至少答两种方法)。
(2)“水解”生成H2TiO3的离子方程式为_________________________。
(3)“沉铁”过程中,气态产物的电子式为__________________;该过程需控制反应温度低于35 ℃,原因为___________________________________________________。
(4)滤液3可用于制备Mg(OH)2。若滤液3中c(Mg2+)=1.0×10-3 mo/L,向其中加入NaOH固体,调整溶液pH值大于________时,可使Mg2+沉淀完全。
(5)“电解”时,电解质为熔融的CaO,两电极材料为石墨棒。则_______极石墨棒需要定期更换,原因是__________________________________________________________。
(6)测定铁红产品纯度:称取m g铁红,溶于一定量的硫酸之中,配成500.00 mL溶液。从其中量取20.00 mL溶液,加入过量的KI,充分反应后,用 c mol/L硫代硫酸钠(Na2S2O3)标准液滴定至终点,发生反应:I2+2S2O![]() ===S4O
===S4O![]() +2I-。平行滴定三次,硫代硫酸钠平均消耗体积为V mL。则铁红产品的纯度为________(用c、V、m表示)。
+2I-。平行滴定三次,硫代硫酸钠平均消耗体积为V mL。则铁红产品的纯度为________(用c、V、m表示)。
【答案】升温、搅拌、适当增大硫酸浓度、粉碎矿石 TiO2++2H2O=H2TiO3↓+2H+ ![]() 温度过高容易导致NH4HCO3分解(或防止Fe2+、Mg2+等受热水解) 11 阳 阳极产生氧气与石墨反应生成二氧化碳,导致阳极损耗
温度过高容易导致NH4HCO3分解(或防止Fe2+、Mg2+等受热水解) 11 阳 阳极产生氧气与石墨反应生成二氧化碳,导致阳极损耗 ![]()
【解析】
根据流程:用硫酸酸浸钛铁矿(主要成分为钛酸亚铁(FeTiO3),含有MgO、SiO2等杂质),SiO2不溶,钛酸亚铁、氧化镁溶解,过滤,滤渣1为SiO2,滤液1含有Fe2+、TiO2+、Mg2+,水解滤液1发生反应:TiO2++2H2O=H2TiO3↓+2H+,过滤得到H2TiO3,煅烧H2TiO3得到TiO2,电解得到Ti;滤液2主要含有Fe2+、Mg2+,加入碳酸氢铵沉铁反应:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,得到FeCO3沉淀和含有Mg2+的滤液3,FeCO3与氧气煅烧得到铁红,据此分析作答。
(1)适当升温。搅拌、适当增大六三浓度、粉碎矿石等可以提高浸取速度和浸取率;
(2)根据分析,滤液1含有TiO2+,水解生成H2TiO3,离子反应为:TiO2++2H2O=H2TiO3↓+2H+;
(3)“沉铁”过程中生成的气体是二氧化碳,其电子式为![]() ;温度过高溶液导致碳酸氢铵分解(或防止Fe2+、Mg2+等受热水解),过沉铁过程过程需控制反应温度低于35℃;
;温度过高溶液导致碳酸氢铵分解(或防止Fe2+、Mg2+等受热水解),过沉铁过程过程需控制反应温度低于35℃;
(4)已知:Ksp[Mg(OH)2]=1.0×10-11,使Mg2+恰好沉淀完全,此时c(OH-)= ![]() mol/L=1.0×10-3mol/L,c(H+)=1.0×10-11mol/L,故pH≥11,Mg2+沉淀完全;
mol/L=1.0×10-3mol/L,c(H+)=1.0×10-11mol/L,故pH≥11,Mg2+沉淀完全;
(5)“电解”时,电解质为熔融的CaO,两电极材料为石墨棒,阳极反应为:2O2--4e-=O2↑,阳极产生的氧气与石墨反应生成二氧化碳,导致阳极损耗,故阳极石墨棒需要定期更换;
(6)铁红溶于稀硫酸得到Fe3+,与KI发生反应:2Fe3++2I-=2Fe2++I2,用硫代硫酸钠(Na2S2O3)标准液滴定生成的碘,有关系式:Fe2O3~2Fe3+~I2~2Na2S2O3,则n(Fe2O3)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() cV×10-3mol,故mg样品中铁红产品的纯度为
cV×10-3mol,故mg样品中铁红产品的纯度为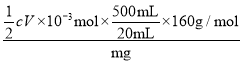 ×100%=
×100%=![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列各项反应对应的图像正确的是( )
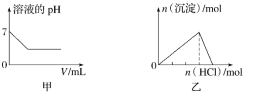
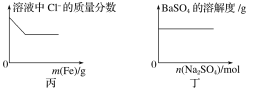
A.图甲为25℃时,向亚硫酸溶液中通入氯气
B.图乙为向NaAlO2溶液中通入HCl气体
C.图丙为向少量氯化铁溶液中加入铁粉
D.图丁为向BaSO4饱和溶液中加入硫酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。下列实验现象中正确的是( )

A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一溶液,欲确定是否含有下列离子:K+、Mg2+、Fe3+、Ba2+、SO42-、Cl-、I-、HCO3-,实验如下:
实验步骤 | 实验现象 |
①用玻璃棒蘸取少量该溶液,点在pH试纸中部 | 试纸变为红色 |
②取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
③取②中反应后的上层清液,加入AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
④取少量该溶液,加入NaOH溶液 | 只有红褐色沉淀生成 |
下列判断正确的是( )
A.溶液中阳离子只有Fe3+
B.由于没有Na+,焰色反应观察K+时不必用蓝色的钴玻璃
C.假如没有步骤①,也不影响溶液中离子的判断
D.步骤④发生反应的离子方程式只有:Fe3++3OH-=Fe(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:
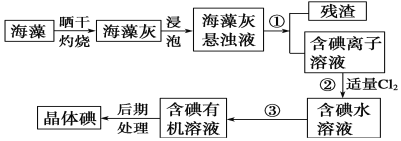
(1)实验室焙烧海带,需要下列仪器中的________________(填序号)。
a.试管b.烧杯c.坩埚d.泥三角e.铁三脚架f.酒精灯
(2)指出提取碘的过程中有关的实验操作③的名称是________________,所用主要仪器是________________。
(3)提取碘的过程中,可选择的有机试剂是________________
A.甲苯、酒精 B.四氯化碳、苯C.汽油、乙酸 D.汽油、甘油
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出实验装置图中的错误之处:
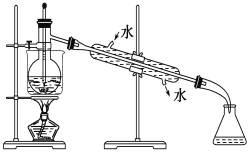
①________________;
②________________;
③________________。
(5)进行上述蒸馏操作时,使用水浴加热的原因是________________,最后晶态碘在________________(填仪器名称)里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究物质结构与性质之间的关系和元素性质的递变规律,设计了如下系列实验。回答下列问题:
I.NaNH2熔点(210℃)比NaOH 熔点(318.4℃)低, 解释原因正确的是 (__________)
A.是因为NaNH2比NaOH 的相对分子质量小,前者分子间作用力小。
B.NaOH存在分子间氢键
C.NaNH2、NaOH均是离子化合物,其熔沸点高低与离子键的强弱有关,阴、阳离子电荷数越高,离子半径越小,离子键强度越大(或离子晶体的晶格能越大),则熔点越高。由于原子半径N>O,且NH2- 比OH- 原子个数多,则NH2- 比OH- 离子半径大,所以NaNH2比NaOH离子晶体的晶格能小,其熔点低。
D.N和O均处于第二周期,N在左方,同周期元素从左到右,元素的非金属性增强,其氢化物水溶液的酸性H2O>NH3,则碱性NaNH2>NaOH
II.根据下图所示装置回答以下问题。

(1)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证Cl的非金属性大于S:锥形瓶中发生反应的离子方程式为_________________________。试管中的实验现象为___________________________。
(2)若要用此装置证明非金属性: N>C>Si,从以下所给物质中选出实验所要用到物质:
①稀HNO3溶液 ②稀硫酸溶液 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2
试剂A与C分别对应为_________________(填数字序号)。
有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为发生干扰的化学方程式为:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) = CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) = 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) = 2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_______。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
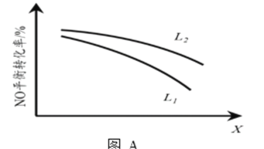
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是___________。判断L1、L2的大小关系,并简述理由:_________。
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_________(填“>”、“<”或 “=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =_____________。(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体粉末中可能含有SiO2、Fe2O3、CuO、NaHCO3、K2CO3,某同学设计并完成如下实验:(所加试剂均过量)

已知:蘸取少量溶液2在酒精灯上灼烧,透过蓝色钴玻璃观察火焰呈紫色。
请回答:
(1)白色沉淀是__________________(填化学式)。
(2)生成红褐色沉淀的离子方程式为______________________。
(3)根据实验现象, 固体粉末中一定存在的组分是___________________________ (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】流动电池是一种新型电池。其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定。北京化工大学新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4=CuSO4+PbSO4+2H2O。下列说法不正确的是

A.a为负极,b为正极
B.该电池工作时PbO2电极附近溶液的pH增大
C.a极的电极反应为Cu-2e-=Cu2+
D.调节电解质溶液的方法是补充CuSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com