
【题目】下列有关葡萄糖的说法错误的是( )
A.葡萄糖的分子式为C6H12O6
B.葡萄糖能发生银镜反应
C.葡萄糖是人体重要的能量来源
D.葡萄糖属于高分子化合物
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】根据元素的单质和化合物的性质,判断元素非金属性强弱的依据一般是
A. 元素最高价氧化物对应的水化物的碱性的强弱
B. 元素氧化物对应的水化物的酸性的强弱
C. 元素的单质与酸反应置换出氢的难易
D. 元素的单质与氢气生成气态氢化物的难易以及氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是:
A. 通入二氧化碳气体 B. 加入氢氧化钡溶液
C. 加入澄清石灰水 D. 加入稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法正确的是( ) 
A.若甲可以与NaOH溶液反应放出H2 , 则丙一定是两性氧化物
B.若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊一定是氧化还原反应
C.若丙、丁混合产生大量白烟,则乙可能具有漂白性
D.若甲、丙、戊都含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+ . 为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据流程图,在方框和括号内填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实验方案. 
(1)操作②的名称为 , 所需要的玻璃仪器为、、烧杯.
(2)试剂⑤的化学式为 , 所发生的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡常用作媒染剂、有机合成中的催化剂,已知SnCl4易水解,溶点为﹣33℃、沸电为114℃.某研究性学习小组设计如图装置(部分夹持装置及加热仪器省略)制备SnCl4 . 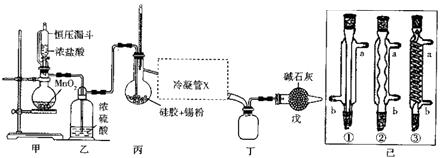
(1)装置甲中反应的离子方程式为 . 整个制备装置中有一处不足,改进的方法是
(2)利用改进后的装置进行实验(下同)时甲、丙均需加热,首先加热的是处的烧瓶,冷凝管x是已中的一种,该仪器的编号是 , 装置戊的用途是 .
(3)实验过程中装置甲中除观察到固体溶解外,还可观察到的明显变化是 .
(4)该小组的甲同学提出,可利用标准NaOH溶液滴定甲中剩余溶液的方法测定出盐酸与MnO2反应的最低浓度.
①滴定时所用指示剂最好是[假设开始出现Mn( OH)2 , 沉淀时的pH约为6,8].
②假设实验时从甲中准确取出V2mL剰余溶液并稀释到V3 mL,然后用0.100 0molL﹣1的 NaOH溶液进行滴定,滴定终点时消耗掉V1mL NaOH溶液,则盐酸与MnO2反应时最低浓度应大于 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生的绿色能源,CO2是一种温室气体,它们都是重要的化工原料.
(1)已知CO的燃烧热△H为﹣283kJmol﹣1 , CO (g)+2H2 (g)CH3OH (1);△H=﹣129kJmol﹣1 , 欲求出CH3OH的燃烧热,则需要知道一个反应,该反应的热化学方程式为 . (反应热直接用△H表示).
(2)向温度不同容积均为1L的a、b、c、d、e五个恒容密闭容器中各充入3molCO2、7molH2O的混合气体,控制适当条件使其同时发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=QkJmol﹣1 , 反应过程中维持各容器温度不变,测得t1时刻各容器中H2O的体积分数(H2O) 如图所示. 
①Q(填“>”或“<”),五个容器中肯定处于非平衡状态的是
②t1时刻时,容器a中正反应速率(填“大于”“小于”或“等于”)容器e中正反应速率.
③Td℃时,该反应的平衡尝试K= .
④欲提高H2的转化率,可采取的措施有(写出两种).
(3)碳捕捉技术的应用既可降低碳排放也可得到重要的化工产品.
①NaOH溶液是常用的碳捕捉剂,若某次捕捉后得到的溶液中c(HCO3﹣):c(CO32﹣)=2:1,则所得溶液的pH=[常温下 K1(H2CO3)=4.4×10﹣7、K2 (HCO3﹣)=5x 1O﹣11].
②在清除锅炉水垢的过程中,需要用Na2CO3将水垢中的CaSO4转化为CaCO3 , 将微溶的CaSO4难溶性的CaCO3的理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把23 g钠投入到m1g足量的水中得到ag溶液,把24 g镁投入到m2g足量的盐酸中得到bg溶液,若m1=m2,则a,b的关系是( )
A.a>b
B.a<b
C.a=b
D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性.
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.2 molL﹣1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2 molL﹣1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1 molL﹣1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3 . 用离子方程式解释现象Ⅰ: .
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42﹣ , 含有Cu+、Cu2+和SO32﹣ .
已知:Cu+ ![]() Cu+Cu2+ , Cu2+
Cu+Cu2+ , Cu2+ ![]() CuI↓(白色)+I2 .
CuI↓(白色)+I2 .
①用稀硫酸证实沉淀中含有Cu+的实验现象是 .
②通过下列实验证实,沉淀中含有Cu2+和SO32﹣ . 
a.白色沉淀A是BaSO4 , 试剂1是 .
b.证实沉淀中含有Cu2+和SO32﹣的理由是 .
(3)已知:Al2(SO3)3在水溶液中不存在.经检验,现象Ⅲ的白色沉淀中无SO42﹣ , 该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色.
①推测沉淀中含有亚硫酸根和 .
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.被Al(OH)3所吸附;ii.存在于铝的碱式盐中.对假设ii设计了对比实验,证实了假设ii成立.
a.将对比实验方案补充完整.
步骤一: 
步骤二:(按图形式呈现).
b.假设ii成立的实验证据是
(4)根据实验,亚硫酸盐的性质有 . 盐溶液间反应的多样性与有关.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com