



科目:高中化学 来源: 题型:
| A、向未知溶液中加入硝酸银溶液,有白色沉淀产生 |
| B、向未知溶液中加入硝酸银溶液,有白色沉淀产生,加入盐酸后.沉淀不消失 |
| C、向未知溶液中加入稀硝酸酸化后,再加入硝酸银溶液,有白色沉淀产生 |
| D、向未知溶液中加入稀盐酸酸化后,再加入硝酸银溶液,有白色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
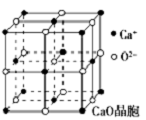 可以由下列反应合成三聚氰胺:CaO+3C
可以由下列反应合成三聚氰胺:CaO+3C
| ||
| ||
 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸 (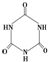 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、检验CO2与Na2O2反应有O2生成,可将CO2气体依次通过Na2O2和浓NaOH溶液,然后收集并用带火星的木条验证 |
| B、除CO2中混有的少量SO2,可依次通过盛有酸性KMnO4溶液、品红溶液的洗气瓶,得纯净CO2 |
| C、检验Fe3O4中混有Fe2O3,可将混合物加入足量稀硫酸溶液,然后取样加入KSCN溶液 |
| D、检验Cl2中混有SO2,可将混合气体通入品红溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、醋酸,D中放有饱和碳酸钠溶液.请回答:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、醋酸,D中放有饱和碳酸钠溶液.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
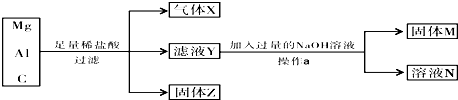
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com