
| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | K、Zn分别与不足量的稀硫酸反应所得溶液均呈中性 | |
| C. | Li、Na、K的原子半径和密度随原子序数的增加而增大 | |
| D. | C、S、Cl的最高价氧化物对应水化物的酸性逐渐增强 |
分析 A、根据氯气具有强氧化性,和铁反应产生氯化铁,而稀盐酸和铁反应产生氯化亚铁分析;
B、根据硫酸钾为强酸强碱盐,而硫酸锌为强酸弱碱盐分析;
C、根据电子层数越多,原子半径越大分析;
D、根据非金属性越强,最高价氧化物对应的水化物的酸性越强分析.
解答 解:A、氯气具有强氧化性,和铁反应产生氯化铁,而稀盐酸和铁反应产生氯化亚铁,故A错误;
B、硫酸钾为强酸强碱盐,而硫酸锌为强酸弱碱盐,因此钾和锌反应产生的氯硫酸钾、硫酸锌分别显中性和酸性,故B错误;
C、电子层数越多,原子半径越大,Li、Na、K的电子层数逐渐增大,因此半径是增大的,但是密度逐渐减小,故C错误;
D、C、S、Cl的非金属性增强,因此最高价氧化物对应的水化物的酸性也逐渐增强,故D正确;
故选D.
点评 本题考查了元素周期表的运用,明确规律并熟练其意义是解题的关键,另外熟练掌握氯气的强氧化性.


科目:高中化学 来源: 题型:选择题
| A. | 38.5mol/L | B. | 32.7mol/L | C. | 20.4mol/L | D. | 18.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
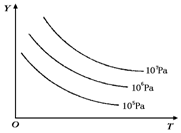 有下列可逆反应:L(s)+G(g)?2R(g)(正反应吸热),外界温度、压强的变化对该反应的影响如图所示:则下列对图中纵坐标Y的含义的有关叙述中正确的是( )
有下列可逆反应:L(s)+G(g)?2R(g)(正反应吸热),外界温度、压强的变化对该反应的影响如图所示:则下列对图中纵坐标Y的含义的有关叙述中正确的是( )| A. | G的转化率 | B. | 平衡混合气中R的体积分数 | ||
| C. | 平衡混合气中G的体积分数 | D. | 平衡混合气中L的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液使蓝色石蕊试纸变红:Fe3++3H2O═3H++Fe(OH)3 | |
| B. | FeCl3溶液中滴加氨水出现红褐色沉淀:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Cu2++Fe2+ | |
| D. | 检验溶液中的Fe3+用KSCN溶液:Fe3++3SCN-?Fe(SCN)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为890.3kJ.mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ.mol-1 | |
| B. | CO(g)的燃烧热是283.0 kJ/mol,则CO2(g)═2CO(g)+O2(g)的反应热△H=+2×283.0 kJ/mol | |
| C. | NaOH和HCl反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$?_{550℃,30Mpa}^{催化剂}$2NH3(g)△H=-38.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | T | X | Y | Z |
| 性质结构信息 | 原子核外s电子总数等于p电子总数;人体内含量最多的元素,且其单质是常见的助燃剂 | 单质为双原子分子,分子中含有3对共用电子对,常温下单质性质稳定,但其原子较活泼 | 第3周期元素的简单离子中半径最小 | 第4周期元素,M电子层为全充满状态,最外层只有一个电子的原子 |
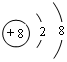 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式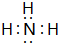 ;X形成的单质分子,含1个σ键,2个π键.写出Z元素原子的外围电子排布式3d104s1;元素Y的原子核外共有2种形状不同的电子云.
;X形成的单质分子,含1个σ键,2个π键.写出Z元素原子的外围电子排布式3d104s1;元素Y的原子核外共有2种形状不同的电子云.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了加快过滤速度,可用玻璃棒搅拌过滤器中的液体 | |
| B. | 在蒸馏时应先打开冷凝水开关,待水充满后再点燃酒精灯 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,然后换一个烧杯将上层液体放出 | |
| D. | 在做蒸馏实验时应将温度计的水银球浸没在液体里 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com