
【题目】第三代永磁体材料——钕铁硼(NdFeB)因其优异的综合磁性能,被广泛应用于计算机、通信信息等高科技产业。
(1)铁、钴、镍元素性质非常相似,原子半径接近但依次减小,NiO、FeO的晶体结构类型与氯化钠相同。基态钴原子价电子轨道表示式为_______,熔沸点:NiO_____FeO(填“<”“>”或“=”)。
(2)FeSO4·(NH4)2SO4·6H2O俗称摩尔盐,相对于FeSO4·7H2O而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制Fe(Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是______________________。
(3)新型储氢材料氨硼烷(NH3BH3)常温下以固体稳定存在,极易溶于水。
①氨硼烷分子中B原子采取_________杂化。
②氨硼烷晶体中存在的作用力有范德华力、极性键、_______和_________。
(4)氨硼烷受热析氢的过程之一如图1所示。

①NH2BH2的氮硼键键能大于NH3BH3,其原因为__________________________。
②CDB的结构简式为___________________________。
③立方氮化硼(BN)晶体的晶胞结构如图2所示。阿伏伽德罗常数值为NA,该晶体的密度为_______g·cm-3(用含a和NA的最简式表示)。图3是立方氮化硼晶胞的俯视投影图,请在图中用“●”标明B原子的相对位置_______。
【答案】![]() > 晶体中H、N、O三种元素之间形成网络化氢键对Fe(Ⅱ)起保护作用 sp3 配位键 氢键 NH2BH2分子中除了存在σ键还存在π键
> 晶体中H、N、O三种元素之间形成网络化氢键对Fe(Ⅱ)起保护作用 sp3 配位键 氢键 NH2BH2分子中除了存在σ键还存在π键 ![]()
![]()

【解析】
(1)Co是27号元素,其3d轨道上7个电子、4s轨道上2个电子为其价电子,据此书写其价电子轨道表示式;NiO、FeO都是离子晶体,离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比、与电荷成正比;
(2)FeSO4·(NH4)2SO4·6H2O晶体中存在电负性大的元素O和N,可以与H元素形成多个氢键,把亚铁离子包围起来避免与氧化性物质接触;
(3)①该分子中存在配位键N-B,导致N、B原子价层电子对个数都是4,根据价层电子对互斥理论判断N、B原子杂化类型;
②B原子和N原子之间存在配位键,N原子和另外分子中的H原子之间形成氢键;
(4)①NH2BH2分子中N、B原子之间存在π键;
②根据第III产物结构简式确定CDB结构简式;
③该晶胞中B原子个数=4、N原子个数=8×![]() +6×
+6×![]() =4,晶胞体积=(a×10-7 cm)3,密度=
=4,晶胞体积=(a×10-7 cm)3,密度= ;4个B在底面上的投影分别位于面对角线
;4个B在底面上的投影分别位于面对角线![]() 处。
处。
(1)Co是27号元素,其3d轨道上7个电子、4s轨道上2个电子为其价电子,据此书写其价电子轨道表示式为![]() ;NiO、FeO都是离子晶体,离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比、与电荷成正比,二者阴阳离子电荷都分别相等,离子半径:r(Ni2+ )<r(Fe2+ ),则晶格能NiO>FeO,所以熔沸点:NiO>FeO,
;NiO、FeO都是离子晶体,离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比、与电荷成正比,二者阴阳离子电荷都分别相等,离子半径:r(Ni2+ )<r(Fe2+ ),则晶格能NiO>FeO,所以熔沸点:NiO>FeO,
故答案为:![]() ;>;
;>;
(2)FeSO4·(NH4)2SO4·6H2O俗称摩尔盐,相对于FeSO4·7H2O而言,摩尔盐不易失水,不易被空气氧化,FeSO4·(NH4)2SO4·6H2O晶体中存在电负性大的元素O和N,可以与H元素形成多个氢键,把亚铁离子包围起来避免与氧化性物质接触,从而保护亚铁离子,
故答案为:晶体中H、O、N三种元素之间形成网络化氢键对Fe(II)起保护作用;
(3)①该分子中存在配位键N-B,导致N、B原子价层电子对个数都是4,根据价层电子对互斥理论判断N、B原子杂化类型都是 sp3,
故答案为:sp3;
②B原子和N原子之间存在配位键,N原子和另外分子中的H原子之间形成氢键,所以还存在配位键、氢键,
故答案为:配位键;氢键;
(4)①NH2BH2分子中除了存在σ键还存在π键导致其键能大于NH3BH3,
故答案为:NH2BH2分子中除了存在σ键还存在π键;
②根据第III产物结构简式确定CDB结构简式为![]() ,
,
故答案为:![]() ;
;
③该晶胞中B原子个数=4、N原子个数=8×![]() +6×
+6×![]() =4,晶胞体积=(a×10-7 cm)3,密度=
=4,晶胞体积=(a×10-7 cm)3,密度= =
=  g·cm-3=
g·cm-3=![]() g·cm-3;4个B在底面上的投影分别位于面对角线
g·cm-3;4个B在底面上的投影分别位于面对角线![]() 处,其图象为
处,其图象为 ,
,
故答案为:![]() ;
; 。
。


科目:高中化学 来源: 题型:
【题目】某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )

A.该温度下,Ksp(CuS)小于Ksp(MnS)
B.向CuSO4溶液中加入MnS发生如下反应:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq)
C.在含有CuS和MnS固体的溶液中c(Cu2+):c(Mn2+)为2×10-23:1
D.a点对应的Ksp大于b点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓度均为0.5mol·L-1的氨水和KOH溶液分别滴入到两份均为20mLc1mol·L-1的AlCl3溶液中,测得溶液的导电率与加入碱的体积关系如图所示。下列说法正确的是

A.c1=0.2
B.b点时溶液的离子浓度:c(C1-)>c(NH4+)>c(OH-)>c(H+)
C.ac段发生的反应为:A1(OH)3+OH-==[Al(OH)4]-
D.d点时溶液中:c(K+)+c(H+)==[Al(OH)4]-+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为FeSmAsFO组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为_______,其沸点比NH3的_______(填“高”或“低”),其判断理由是_________________________。
(2)Fe成为阳离子时首先失去______轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为______________________。
(3)比较离子半径:F__________O2(填“大于”等于”或“小于”)。
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。

图中F和O2共同占据晶胞的上下底面位置,若两者的比例依次用x和1x代表,则该化合物的化学式表示为____________,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________g·cm3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(![]() ),则原子2和3的坐标分别为__________、__________。
),则原子2和3的坐标分别为__________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物J属于大位阻醚系列中的一种物质,在有机化工领域具有十分重要的价值.2018年我国首次使用α-溴代羰基化合物合成大位阻醚J,其合成路线如下:

已知:
回答下列问题:
(1)A 的名称___________________.
(2)C →D的化学方程式_________________________.E →F的反应类型____
(3)H 中含有的官能团________________.J的分子式_______________.
(4)化合物X是D的同分异构体,其中能与氢氧化钠溶液反应的X有_____________种(不考虑立体异构),写出其中核磁共振氢谱有3组峰,峰面积之比为1∶1∶6的结构简式为___________________________.
(5)参照题中合成路线图。涉及以甲苯和 为原料来合成另一种大位阻醚
为原料来合成另一种大位阻醚 的合成路线:__________________。
的合成路线:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的△H(化学计量数相同)分别为△H1、△H2,△H1_____△H2(填“>”“<”或“=”,下同)。
(2)相同条件下,1 mol P4所具有的能量_______4 mol P原子所具有的能量。
(3)己知P4(白磷,s)![]() 4P(红磷,s) △H=-17 kJ· mol-1,比较下列反应中△H的大小:△H1_____△H2。
4P(红磷,s) △H=-17 kJ· mol-1,比较下列反应中△H的大小:△H1_____△H2。
①P4(白磷,s)+5O2(g)=P4O10(s) △H1,
②4P(红磷,s)+5O2(g)=P4O10(s) △H2。
(4)己知:稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ· mol-1,则浓硫酸与稀氢氧化钠溶液反应生成2 mol水,放出的热量______114.6kJ。
(5)己知:28gFe(s)与CO2(g)在一定条件下,完全反应生成FeO(s)和CO(g),吸收了a kJ热量,该反应的热化学方程式是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的离子是( )
A.①③⑤⑦⑧B.②④⑥⑧C.①⑥D.②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H的分子中含有醛基和酯基。H可以用C和F在一定条件下合成(如图):
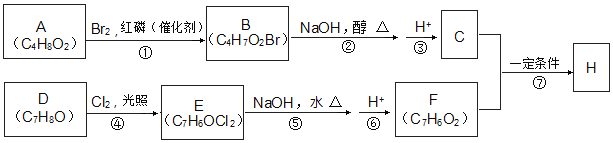
已知以下信息:
①A的核磁共振氢谱中有三组峰;且能与饱和碳酸氢钠溶液反应放出CO2。
②RCH2COOH 。
。
③化合物D苯环上的一氯代物只有两种。
④通常同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
(1)A的名称为___。
(2)D的官能团名称为___。
(3)反应②的化学方程式为__,⑦的反应类型为___。
(4)F的结构简式为__。
(5)H在一定条件下反应生成高聚物的化学方程式为___。
(6)F的同系物G比F相对分子质量大14,G的同分异构体中能同时满足如下条件:
①苯环上只有两个取代基;②不能使FeCl3溶液显色,共有__种(不考虑立体异构)。其中能与碳酸氢钠溶液反应且核磁共振氢谱为4组峰,且峰面积比为3:2:2:1,写出G的这种同分异构体的结构简式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发酵法制酒精的过程可粗略表示如下:
①(C6H10O5)n+nH2O![]() nC6H12O6 ②C6H12O6
nC6H12O6 ②C6H12O6![]() 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
(1)上述化学方程式中(C6H10O5)n可能表示_____ ____(填物质名称);
(2)C6H12O6名称是_________,常用_____ ____试剂来检验其存在;
(3)为检验苹果成熟过程中发生了反应①,可在青苹果汁中滴加碘酒,溶液呈_________色,向熟苹果汁中加入Cu(OH)2悬浊液,加热,反应生成____ ____(填实验现象);
(4)下列作用不属于水解反应的是_________
A.吃馒头时多咀嚼后有甜味
B.淀粉溶液和稀硫酸共热一段时间后,滴加碘水不显蓝色
C.不慎将浓硝酸沾到皮肤上会出现黄色斑痕
D.油脂与氢氧化钠溶液共煮后可以制得肥皂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com