
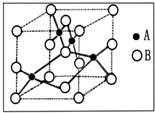
 金属铜广泛地应用于电气、机械制造、国防等领域.
金属铜广泛地应用于电气、机械制造、国防等领域.| m |
| V |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| M×4 |
| NA?V |
| 80×4 |
| NA?(a×10-7)3 |
| 80×4 |
| NA?(a×10-7)3 |
| 6+2-2×4 |
| 2 |


科目:高中化学 来源: 题型:
| A、①②④ | B、③⑤ |
| C、②③④⑤ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组利用下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计B用于准确测量通过的尾气体积.将尾气通入一定体积已知浓度的碘水中测定SO2的含量.当洗气瓶C中溶液蓝色消失时,立即关闭活塞A.
某化学兴趣小组利用下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计B用于准确测量通过的尾气体积.将尾气通入一定体积已知浓度的碘水中测定SO2的含量.当洗气瓶C中溶液蓝色消失时,立即关闭活塞A.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气具有酸性,可与烧碱或石灰乳反应制备含氯消毒剂 |
| B、稀硝酸具有强氧化性,常温下可用铝罐盛装 |
| C、氢氟酸具有弱酸性,可用氢氟酸雕刻玻璃 |
| D、氢氧化铝是两性氢氧化物,可用与治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、烷烃的熔沸点随分子中碳原子数的增多而降低 |
| B、甲烷和乙烯在一定条件下都可以与氯气反应 |
| C、高锰酸钾溶液可以氧化乙烯和甲烷 |
| D、乙烯可以与氢气、HCl发生加成反应,也可发生自身加聚反应生成聚氯乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com