
| A. | 标准状况下,2.24LCCL4含有0.1NA个CCL4 | |
| B. | 7.8gNa2O2中所含阴离子的数目是0.1NA | |
| C. | 含NA个Na的Na2O溶解于1L水中,Na的物质的量浓度为1mol/L | |
| D. | 常温下,1LpH=1的CH4COOH溶液加水稀释后H+数目为0.1NA |
分析 A.气体摩尔体积使用对象为气体;
B.过氧化钠中阴离子为过氧根离子,1mol过氧化钠含有1mol过氧根离子;
C.0.5mol氧化钠溶于1L水中,溶液的体积未知,不能计算浓度;
D.醋酸为弱电解质,加水稀释醋酸溶液,可以促进醋酸的电离.
解答 解:A.标况下四氯化碳为液体,不能使用气体摩尔体积,故A错误;
B.7.8gNa2O2物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,所含阴离子过氧根离子的数目是0.1NA,故B正确;
C.含NA个Na+的Na2O,物质的量为0.5mol,溶解于1L水中,溶液的体积无法计算,不能知道氢氧化钠的物质的量浓度,故C错误;
D.醋酸为弱电解质,加水稀释醋酸溶液,可以促进醋酸的电离,所以1LpH=1的CH4COOH溶液加水稀释后H+数目大于0.1NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的分析应用,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确气体摩尔体积的条件应用是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol H2O的质量为36g/mol | |
| B. | NH3的摩尔质量为17g | |
| C. | 3.01×1023个SO2分子的质量为32g | |
| D. | 标准状况下,3 mol任何物质体积均为67.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
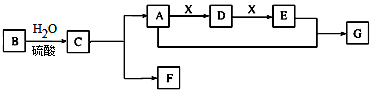
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2+3H2=2NH3属于自然固氮 | |
| B. | 固氮属于氧化还原反应 | |
| C. | 俗语“雷雨发庄稼”毫无科学道理 | |
| D. | 氨气溶于水得到的溶液能导电,所以NH3是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
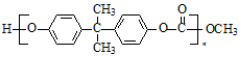

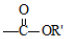 +
+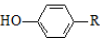 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$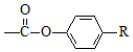 +HOR′
+HOR′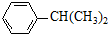 .
.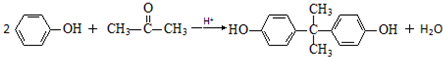 .
.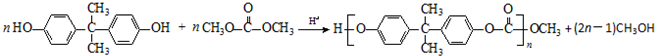 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质 | B. | 脂肪 | C. | 多糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com