
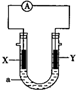
| A. | X为负极,电极反应为:Al-3e-═Al3+ | |
| B. | X为正极,电极反应为:2H2O+O2+4e-═4OH- | |
| C. | Y为负极,电极反应为:Mg-2e-═Mg2+ | |
| D. | Y为正极,电极反应为:2H2O+2e-═2OH-+H2↑ |
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| 残留的固体 | 排放的气体 | |
| A | Na2CO3 | O2、CO2和H2O(g) |
| B | K2CO3 、Na2CO3 | O2和H2O(g) |
| C | NaOH、K2CO3 | O2和CO2 |
| D | Na2O2、NaOH、Na2CO3 | O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
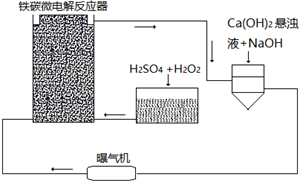
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
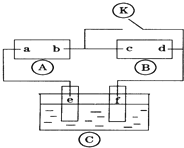 图中
图中 为直流电,
为直流电, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀池.接通电路后发现
为电镀池.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A. | b为直流电的正极 | B. | e电极为铁 | ||
| C. | f极发生还原反应 | D. | d极发生的反应为:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1 mol CaC2、KHSO4的混合物中含阴、阳离子的总数为3NA | |
| B. | 0.1 mol C2H5OH中所含C-H键的数目为0.6NA | |
| C. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| D. | 78gNa2O2与足量水反应转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
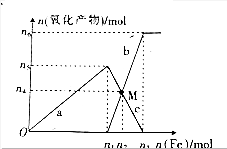 与加入铁粉的物质的量的关系如图所示.
与加入铁粉的物质的量的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生还原反应的是C2O42- | |
| B. | 该离子方程式右侧横线上的产物是OH- | |
| C. | 10molH+参加反应时,电子转移5mol | |
| D. | 该反应的氧化剂为KMnO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
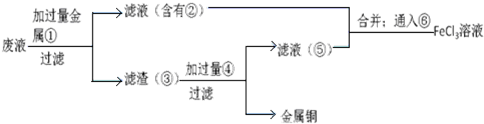
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com