
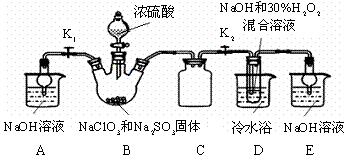
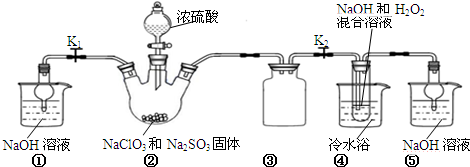
���� ��1������������;ѡȡ������
��2��װ��C�������ǰ�ȫƿ���з��������ã�
��3��װ��B���Ʊ��õ�ClO2������B�з�ӦΪNaClO3��Na2SO3��ŨH2SO4���������� ClO2��Na2SO4���������Ⱥ��������Ʒ�Ӧ����NaClO2��
��4������Ŀ��Ϣ��֪��Ӧ�����¶�38�桫60�棬����60��ʱNaClO2�ֽ��NaClO3��NaCl��
��5����װ��D����Һ���NaClO2���壬��Ҫ�����ᾧ�����ȹ��ˡ�ϴ�ӡ����
��6��B�п��ܷ���Na2SO3+H2SO4��Ũ��=Na2SO4+SO2��+H2O��������SO2 ������D�У�SO2��H2O2 ��Ӧ���������ƣ�
��7���ٵ������۱���ɫ����Ӧ����ʱ���ⷴӦ��ȫ���μ����һ��Na2S2O3��Һʱ��Һ��ɫǡ����ȥ�Ұ�����ڲ���ԭ��˵������ζ��յ㣻
�ڸ��ݻ�ѧ��Ӧ�ɵù�ϵʽ��NaClO2��2I2��4S2O32-������Ʒ��NaClO2�����ʵ���x�����ݹ�ϵʽ���㣮
��� �⣺��1����50%˫��ˮ����30%��H2O2��Һ����Ҫ����������Ͳ���ձ���������������ιܣ����Ի���Ҫ��Ͳ���ʴ�Ϊ����Ͳ��
��2��װ��C�������ǰ�ȫƿ����ֹDƿ��Һ������Bƿ�У��ʴ�Ϊ����ֹDƿ��Һ������Bƿ�У���ȫƿ����
��3��װ��B���Ʊ��õ�ClO2������B�з�ӦΪNaClO3��Na2SO3��ŨH2SO4���������� ClO2��Na2SO4����Ӧ�ķ���ʽΪ2NaClO3+Na2SO3+H2SO4=2 ClO2��+2Na2SO4+H2O���������Ⱥ�˫��ˮ���������Ʒ�Ӧ����NaClO2����Ӧ����ʽΪ2ClO2+2NaOH+H2O2=2NaClO2+O2+2H2O��
�ʴ�Ϊ��2ClO2+2NaOH+H2O2=2NaClO2+O2+2H2O��
��4������Ŀ��Ϣ��֪��Ӧ�����¶�38�桫60�棬����60��ʱNaClO2�ֽ��NaClO3��NaCl�����������ȥD�е���ˮԡ�����ܵ��²�Ʒ�л��е�������NaClO3��NaCl��
�ʴ�Ϊ��NaClO3��NaCl��
��5����װ��D����Һ���NaClO2���壬��Ҫ�����ᾧ�����ȹ��ˡ�ϴ�ӡ�������������Ե�iii��������45�����ҵ���ˮϴ��3�飨��ˮ�¶ȸ���38�棬����60�棩���ʴ�Ϊ����45�����ҵ���ˮϴ��3�飨��ˮ�¶ȸ���38�棬����60�棩��
��6��B�п��ܷ���Na2SO3+H2SO4��Ũ��=Na2SO4+SO2��+H2O��������SO2 ������D�У�SO2��H2O2 ��Ӧ���������ƣ�Ũ�����ѻӷ������������ѻӷ����Σ��������D����a��ȷ��b��c����ѡ��a��
��7���ٵ������۱���ɫ����Ӧ����ʱ���ⷴӦ��ȫ���μ����һ��Na2S2O3��Һʱ��Һ��ɫǡ����ȥ�Ұ�����ڲ���ԭ��˵������ζ��յ㣬
�ʴ�Ϊ���μ����һ��Na2S2O3��Һʱ����Һ��ɫǡ����ȥ�Ұ�����ڲ���ԭ��˵������ζ��յ㣻
������Ʒ��NaClO2�����ʵ���x����
NaClO2��2I2��4S2O32-��
1mol 4mol
0.25x c mol•L-1��V��10-3L
��x=c•V•10-3mol��
�ʴ�Ϊ��c•V•10-3mol��
���� ���⿼�����������Ʊ�ʵ��Ļ����������������Ƶ����ʼ��к͵ζ���֪ʶ������ԭ���ǽ���Ĺؼ���ͬʱ����ѧ���������⡢���������������ѵ�������ͼ�ķ�������Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������ͭ�Ǻϳ��������������в���--��������ͭ����Ҫǰ����֮һ������������һ��ʵ���Һϳ�·�ߣ�
������ͭ�Ǻϳ��������������в���--��������ͭ����Ҫǰ����֮һ������������һ��ʵ���Һϳ�·�ߣ�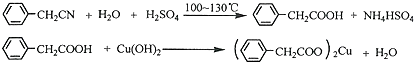
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

| ���� | �۵�/�� | �е�/�� | �ܽ��� |
| �������� | 114.3 | 305 | ������ˮ����������ˮ |
| ���� | -6 | 184.4 | ����ˮ |
| ���� | 16.6 | 118 | ������ˮ |
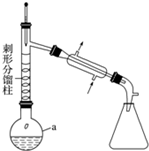
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
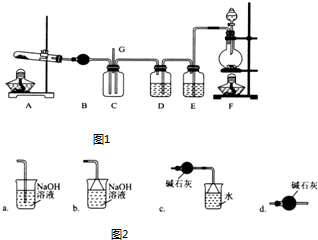
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
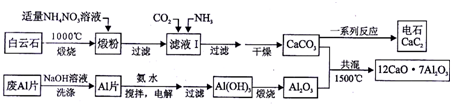
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
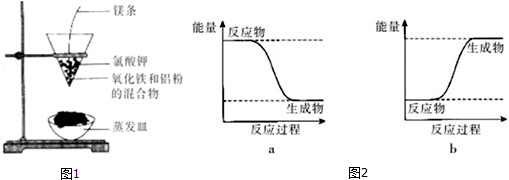
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 400mL | B�� | 600mL | C�� | 800mL | D�� | 1000mL |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com