
与MnO2Zn电池类似,K2FeO4Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应为____________,该电池总反应的离子方程式为_________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列有关铁元素的叙述中正确的是 ( )
A.Fe(OH)2易被氧化成Fe(OH)3,说明稳定性:Fe(OH)2<Fe(OH)3
B.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3
C.氢氧化铁与氢碘酸反应:Fe(OH)3+3HI====FeI3+3H2O
D.铁元素位于周期表的第4周期第Ⅷ族
查看答案和解析>>
科目:高中化学 来源: 题型:
能源短缺是人类社会面临的重大
问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g)
CH3OH(g)
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
则CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=
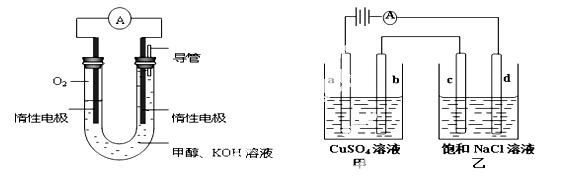
(3)某实验小组依据甲醇燃烧的反应原理,设计如下左图所示的电池装置。
① 该电池负极的电极反应为 。
② 工作一段时间后,测得溶液的pH (填增大、不变、减小)。
③用该电池作电源,组成如下右图所示装置(a、b、c、d均为石墨电极),甲容器装250mL0.04mol/LCuSO4溶液,乙容器装300mL饱和NaCl溶液,写出c电极的电极反应 ,常温下,当300mL乙溶液的pH为13时,断开电源,则在甲醇电池中消耗O2的体积为 mL(标准状况) ,电解后向甲中加入适量下列某一种物质 ,可以使溶液恢复到原来状态,该物质是 (填写编号) 。
A.CuO B.CuCO3 C.Cu(OH)2 D.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
为检验某溴代烃(R-Br)中的溴元素,有下列实验操作:
①加热煮沸 ②加入AgNO3溶液 ③取少量卤代烃 ④加入稀硝酸酸化 ⑤加入NaOH溶液 ⑥冷却,正确 操作的先后顺序是 ( )
操作的先后顺序是 ( )
A. ③①⑤⑥②④ B.③①②⑥④⑤
③①⑤⑥②④ B.③①②⑥④⑤
C.③⑤①⑥④② D.③⑤①⑥②④
查看答案和解析>>
科目:高中化学 来源: 题型:
一种新型熔融盐燃料电池具有高发电效率.现用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO
气体,另一极通O2和CO2混合气体,其总反应为:2CO+O2===2CO2.则下列说法中正确的是 ( )
A.通CO的一极是电池的正极
B.负极发生的电极反应是:O2+2CO2+4e-===2CO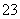
C.负极发生的电极反应是:CO+CO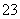 -2e-===2CO2
-2e-===2CO2
D.正极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关用惰性电极电解AgNO3溶液一段时间后的说法正确的是 ( )
A.电解过程中阳极质量不断增加
B.电解过程中溶液的pH不断升高
C.此时向溶液中加入适量的Ag2O固体可使溶液恢复到电解前的状况
D.电解后两极产生的气体体积比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙
述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+) ( )
A.阳极发生还原反应,其电极反应式:Ni2++2e-===Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
查看答案和解析>>
科目:高中化学 来源: 题型:
溴及其化合物广泛用在有机合成、化学分析等领域。
(1)海水提溴过程中溴元素的变化如下 :
:
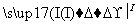
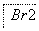
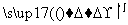
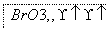
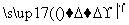
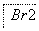
①过程Ⅰ,海水显碱性,调其pH<3.5后,再通入氯气。
ⅰ.通入氯气后,反应的离子方程式是_______________________。
ⅱ.调海水pH可提高Cl2的利用率,用平衡原理解释其原因是______。
②过程Ⅱ,用热空气将溴赶出,再用浓碳酸钠溶液吸收。完成并配平下列方程式。
 Br2+
Br2+ Na2CO3===
Na2CO3=== NaBrO3+
NaBrO3+ CO2+
CO2+ ________
________
③过程Ⅲ,用硫酸酸化可得Br2和Na2SO4的混合溶液。
相同条件下,若用盐酸酸化,则所得溴的质量减少,原因是__________是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6 mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
| 粒子 | I2 | Br2 | IO |
| 物质的量/mol | 0.5 | 1.3 |
则原溶液中NaI的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1。下列有关X的说法中不正确的是 ( )
A.X能形成化学式为X(OH)3的碱
B.X能与某些金属元素形成化合物
C.X原子的最外层电子数和核电荷数肯定为奇数
D.X可能形成化学式为KXO3的盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com