
| A、硫离子的电子排布式:1s22s22p63s23p4 |
B、H2O的电子式: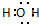 |
C、N原子最外层电子的轨道表示式: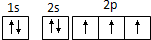 |
D、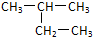 的名称:2-乙基丙烷 的名称:2-乙基丙烷 |
 ;
;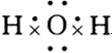 ,故B正确;
,故B正确; ,故C错误;
,故C错误;

科目:高中化学 来源: 题型:
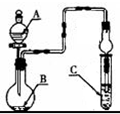
| A、若A为浓硫酸,B为铜,C中盛品红溶液,则C中溶液褪色 |
| B、若A为醋酸,B为贝壳,C中盛CaCl2溶液,则C中溶液变浑浊 |
| C、若A为浓盐酸,B为MnO2,C中盛KI-淀粉溶液,则C中溶液变蓝 |
| D、若A为水,B为Na2O2固体,C中盛氢硫酸溶液,则C中溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:
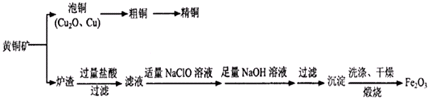
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
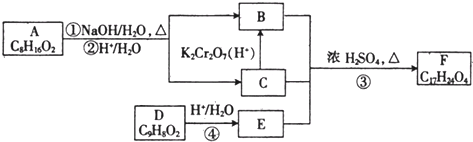
 可以由下列反应合成三聚氰胺:CaO+3C
可以由下列反应合成三聚氰胺:CaO+3C
| ||
| ||
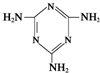 俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸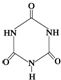 后,三聚氰酸与三聚氰胺分子相互之间通过
后,三聚氰酸与三聚氰胺分子相互之间通过查看答案和解析>>
科目:高中化学 来源: 题型:
 FeCl3在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:
FeCl3在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com