氢气是清洁的能源,也是重要的化工原料.
(1)以H
2为原料制取氨气进而合成CO(NH
2)
2的反应如下:
N
2(g)+3H
2(g)=2NH
3(g)△H=-92.40kJ?mol
-12NH
3(g)+CO
2(g)=NH
2CO
2NH
4(s)△H=-159.47kJ?mol
-1NH
2CO
2NH
4(s)=CO(NH
2)
2(s)+H
2O (l)△H=+72.49kJ?mol
-1则N
2(g)、H
2(g)与CO
2(g)反应生成CO(NH
2)
2(s)和H
2O(l)的热化学方程式为
.
(2)CO在催化剂作用下可以与H
2反应生成甲醇CO(g)+2H
2(g)?CH
3OH(g).在密闭容器中充有10mol CO与20mol H
2,CO的平衡转化率与温度、压强的关系如右图所示.
①M、N两点平衡状态下,容器中总物质的物质的量之比为:n(M):n(N)=
.
②若M、N、Q三点的平衡常数K
M、K
N、K
Q的大小关系为
.
(3)已知叠氮酸(HN
3)不稳定,同时也能与活泼金属反应,反应方程式为:
2HN
3=3N
2↑+H
2↑ 2HN
3+Zn=Zn(N
3)
2+H
2↑
则2mol HN
3与一定量Zn完全反应,在标准状况下生成67.2L气体,其中N
2的物质的量为
.
(4)已知H
2S高温热分解制H
2的反应为:H
2S(g)?H
2(g)+
S(g),在恒容密闭容器中,H
2S的起始浓度均为c mol?L
-1时测得不同温度时H
2S的转化率.图2中 a为H
2S的平衡转化率与温度关系曲线,b为不同温度下反应经过相同时间时H
2S的转化率.若985℃时,反应经t min达到平衡,此时H
2S的转化率为40%,则反应速率v(H
2)=
(用含c、t的代数式表示).请说明随温度的升高,曲线b向曲线a逼近的原因:
.
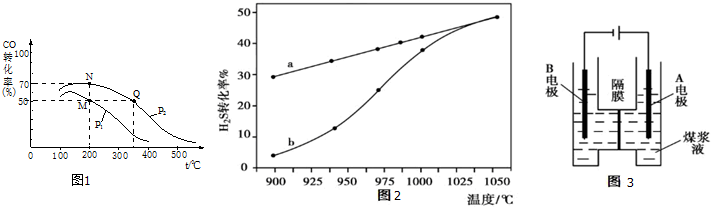
(5)用惰性电极电解煤浆液制H
2的反应为:C(s)+2H
2O(l)=CO
2(g)+2H
2(g) 现将一定量的1mol?L
-1H
2SO
4溶液和适量煤粉充分混合,制成含碳量为0.02g?mL
-1~0.12g?mL
-1的煤浆液,置于图3所示装置中进行电解(两电极均为惰性电极),则A极的电极反应式为
.



